قبلاً در مورد اینکه چگونه قانون کولن – جاذبه و دافعه بین بارها – بر خواص اتم ها تأثیر می گذارد و مسئول پدیده پیوند شیمیایی است صحبت کرده ام. بیاید مرور کنیم.
- اتم ها جفت های الکترونی را بین خود به اشتراک می گذارند. به این روابط پیوندهای شیمیایی می گویند.
- اتم ها دارای خاصیتی به نام الکترونگاتیوی هستند که نشان دهنده میزان جذب الکترون ها به سمت خود است.
در اینجا پیامد مهم این دو واقعیت است: هنگامی که پیوندهایی بین اتم های الکترونگاتیوی متفاوت تشکیل می شود، جفت الکترون در پیوند به طور مساوی تقسیم نمی شود. خواهد بود قطبی شده به سمت اتمی با الکترونگاتیوی بیشتر. این به این معنی است که عنصر الکترونگاتیو بیشتر، چگالی الکترونی بیشتری خواهد داشت (بار منفی خالص) و عنصر الکترونگاتیو کمتر، چگالی الکترونی کمتری (بار مثبت خالص) خواهد داشت.
هرچه اختلاف الکترونگاتیوی بیشتر باشد، قطبش بیشتر است.
گاهی اوقات “اشتراک” الکترون ها برای تشکیل یک پیوند فقط به اشتراک گذاری در نام است. فرض کنید والدین دو پسر 10 و 8 ساله، یک اسکناس 20 دلاری به آنها میدهند تا بینشان تقسیم کنند و از آنجا دور میشوند. با فرض عدم دخالت بیشتر والدین، به نظر شما احتمال اینکه پول 50/50 تقسیم شود چقدر است؟ بسیار باریک (از تجربه شخصی صحبت می کنم). اگرچه دو برادر هستند به صورت اسمی با 20 دلار به اشتراک گذاری، این برادر بزرگتر است که قدرت ارائه یک نلسون کامل نشکن را دارد و بنابراین اکثریت قدرت خرید را در اختیار دارد.
در مورد اتم ها هم همینطور است. در یک انتهای مقیاس شما پیوندهای یک عنصر بسیار الکترونگاتیو مانند فلوئور را با یک عنصر الکترونگاتیو ضعیف مانند لیتیوم دارید. در لیتیوم فلوراید، پیوند به قدری قطبی شده است که اساساً می توان الکترون لیتیوم را منحصراً بر روی فلوئور قرار داد، به طوری که فلوئور دارای یک اکتت کامل است. به این نوع پیوند یونی می گویند [ions = charged atoms or molecules] و پیوند اساساً مانند جاذبه بین دو بار نقطه ای عمل می کند که از قانون کولن پیروی می کنند.
در انتهای دیگر مقیاس، میتوانید عنصری مانند فلوئور را به خود متصل کنید، جایی که هیچ دوقطبی وجود ندارد (تفاوت الکترونگاتیوی صفر است) و از این رو پیوند یونی نیست، بلکه چیزی است که ما کووالانسی مینامیم – یک مشارکت کامل و برابر.
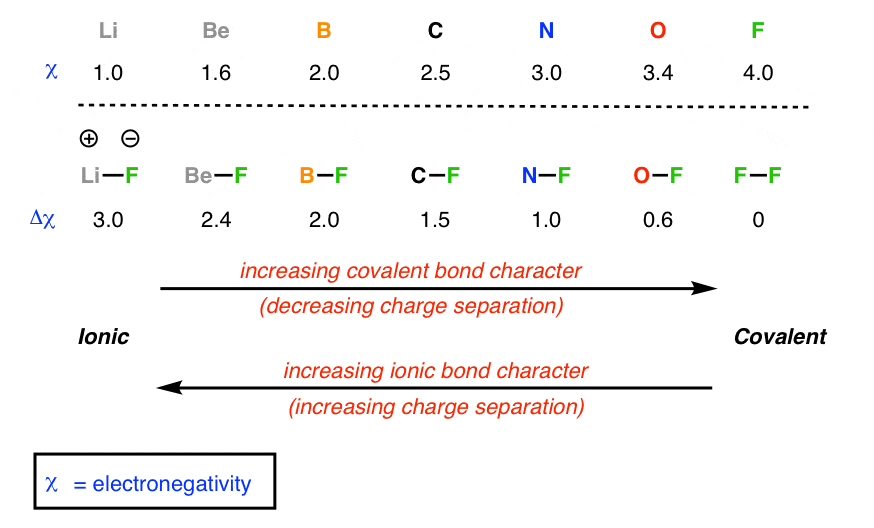
در بین افراطی ها سایه هایی از هر دو وجود دارد. در اینجا یک نکته مهم وجود دارد. همانطور که باید در نگاه کردن به مسائل سیاه و سفید مردد بود، پیوند شیمیایی نیز تفاوتی ندارد. این وسوسه وجود دارد که به پیوندها به عنوان کووالانسی یا یونی نگاه کنیم. درعوض، نگاه کردن از نظر طعم یا ویژگی ممکن است مفیدتر باشد – پیوندها می توانند مقادیر متفاوتی از کووالانسی یا یونی داشته باشند. شخصیت. بنابراین موارد میانی دارای سایه های زیادی از هر دو هستند.
پس این چه پیامدهایی برای شیمی آلی دارد؟ خیلی زیاد است که بتوان در مورد آنها عمیق صحبت کرد! این پدیده کلیدی است که زیربنای بسیاری از غنای شیمی است. اما در اینجا چند نمونه وجود دارد.
- نقاط جوش/نقاط ذوب – به طور کلیهرچه مولکول پلاریزه تر باشد، نقطه جوش/نقطه ذوب بالاتر است. آب یک مولکول بسیار قطبی شده است، با توجه به تفاوت الکترونگاتیوی بین اکسیژن (3.4) و هیدروژن (2.2) که در نقطه جوش بسیار بالای آن (نسبت به وزن مولکولی آن) 100 درجه سانتیگراد منعکس شده است.
- انحلال پذیری – احتمالاً شما با این شعار به راحتی به خاطر سپرده شده اید “مثل مانند را حل می کند”. منn عمومیهرچه مولکول پلاریزه تر باشد، حلالیت آن در یک حلال قطبی (مانند آب، با پیوندهای OH قطبی شده آن) بهتر خواهد بود.
- اسیدیته – الکترونگاتیوی اتم متصل به هیدروژن یک عامل مهم (البته نه تنها!) در تعیین اسیدیته یک مولکول است.
- واکنش پذیری – برای شیمی آلی، این برای اهداف بررسی کربن بسیار مهم است. اتمهای با چگالی الکترونی بالا تمایل به تشکیل پیوند در کربنهایی با چگالی الکترونی کم دارند و بالعکس.
یادگیری تشخیص دوقطبی ها در کربن یکی از مهارت های کلیدی است که به شما در تعیین واکنش پذیری آن کمک می کند، همانطور که وقتی در مورد الکتروفلیسیت (کمبود الکترون) و هسته دوستی (غنای الکترونی) یاد می گیرید خواهید دید.
قیاس ها
من اغلب به الکترونگاتیوی به عنوان یکی از عوامل کلیدی که به اتم ها شخصیت منحصر به فرد آنها می بخشد فکر می کنم. اگر به قیاس عجیب من از اتم ها به عنوان چوپان و الکترون ها به عنوان گوسفند برگردیم، می توانید الکترونگاتیوی را بسیار شبیه به طمع بدانید. حریص ترین چوپان، فلوروس، با (یک) چوپان دیگر شریک می شود تا بتواند از قانون اکتاویوس پیروی کند، اما مشارکت هایی که او وارد می کند معمولاً به دور از هم هستند (فلوروس را به عنوان گوردون گکو دنیای چوپان کوچک ما در نظر بگیرید). فلوروس تا آنجا که ممکن است جفت گوسفند را نزد خود احتکار می کند و چوپان دیگر را در معامله تا حدودی بی ثمر می گذارد.
این یک توضیح مختصر از یکی از اساسی ترین مفاهیم در شیمی است، اما ما بارها و بارها به آن باز خواهیم گشت. گرفتن پیغام خانگی: به تفاوت های الکترونگاتیوی بین اتم ها دقت کنید!
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 9 – اسیدها و بازها
(پیشرفته) مراجع و مطالعه بیشتر
- اصول الکترونگاتیوی قسمت اول. طبیعت عمومی. آر تی ساندرسون مجله آموزش شیمی 1988 65 (2)، 112
DOI: 10.1021/ed065p112 - اصول الکترونگاتیوی قسمت دوم. برنامه های کاربردی. آر تی ساندرسون مجله آموزش شیمی 1988 65 (3)، 227
DOI: 10.1021/ed065p227
این دو مقاله توسط RT Sanderson از دانشگاه ایالتی آریزونا یک بحث مختصر و بسیار واضح در مورد مفهوم الکترونگاتیوی، چگونگی اندازهگیری آن از نظر تاریخی، و چگونگی بهبود آن، و همچنین بحثی در مورد اهمیت هزینه های جزئی در کمک به درک دانش آموزان از واکنش های شیمیایی.
