اساساً سه کاربرد برای سازه های لوئیس وجود دارد. آنها به شما کمک می کنند تا با قرارگیری الکترون ها در اطراف اتم ها آشنا شوید، به تجسم هندسه مولکولی و در نهایت به خاطر سپردن مکان جفت های تنها کمک کنند. همانطور که در Org 1 خواهید دید، هندسه مولکول ها و همچنین قرارگیری جفت های تنها تأثیر زیادی بر واکنش پذیری دارد، بنابراین استفاده از ساختارهای لوئیس برای آشنایی مجدد با این اصول، تمرین ارزشمندی خواهد بود.
ساختارهای لوئیس چیست؟
آنها راهی برای کشیدن مولکول هایی هستند که محل قرارگیری الکترون ها را بین اتم ها نشان می دهند. به عنوان مثال، در اینجا ساختارهای نقطه لوئیس دی کلرید بریلیم، بوران، متان، آمونیاک، آب و اسید هیدروفلوئوریک وجود دارد.
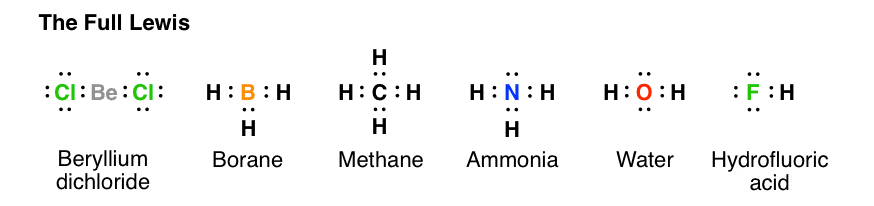
مزیت لوئیس کامل این است که به شما این امکان را می دهد که ببینید همه الکترون ها کجا هستند و تعیین کنید که آیا هر اتم از قانون اکتت پیروی می کند یا خیر. میتوانید به وضوح ببینید که مولکولها میتوانند هر دو الکترون پیوندی داشته باشند، که بین اتمها و الکترونهای غیرپیوندی مشترک هستند، که در غیر این صورت به عنوان جفتهای تنها شناخته میشوند.
لوئیس کامل به نوعی مانند چرخ های تمرینی روی دوچرخه است. زمانی مفید است که تازه شروع کرده اید و در مورد این تجارت اتم ها، الکترون ها و مولکول ها احساس ناراحتی می کنید، و می خواهید برای خودتان تعیین کنید که قانون اکتت در واقع یک پدیده گسترده است که (بیشتر) مولکول ها از آن پیروی می کنند. [the exceptions here being beryllium and boron, which are electron-deficient].
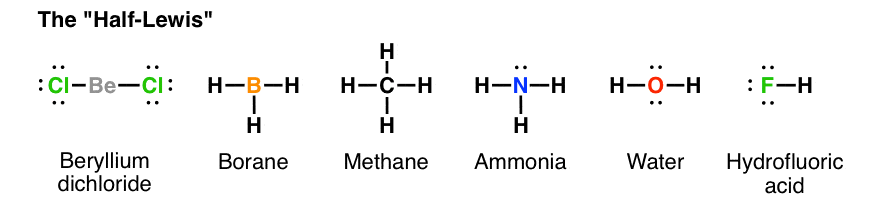
با این حال، شما به سرعت متوجه خواهید شد که کشیدن یک ساختار کامل لوئیس در واقع نوعی دردسر است. هنگامی که با اصول ترسیم مولکول ها آشنا شدید، متوجه می شوید که کار بسیار کمتری است که به سادگی خطی را که در آن پیوند قرار دارد، بکشید، همانطور که در زیر نشان داده شده است. این همچنین این مزیت را دارد که نشان دادن هندسه با استفاده از پیوندهای خطی بسیار ساده تر است، زیرا درهم ریختگی کمتری دارد.
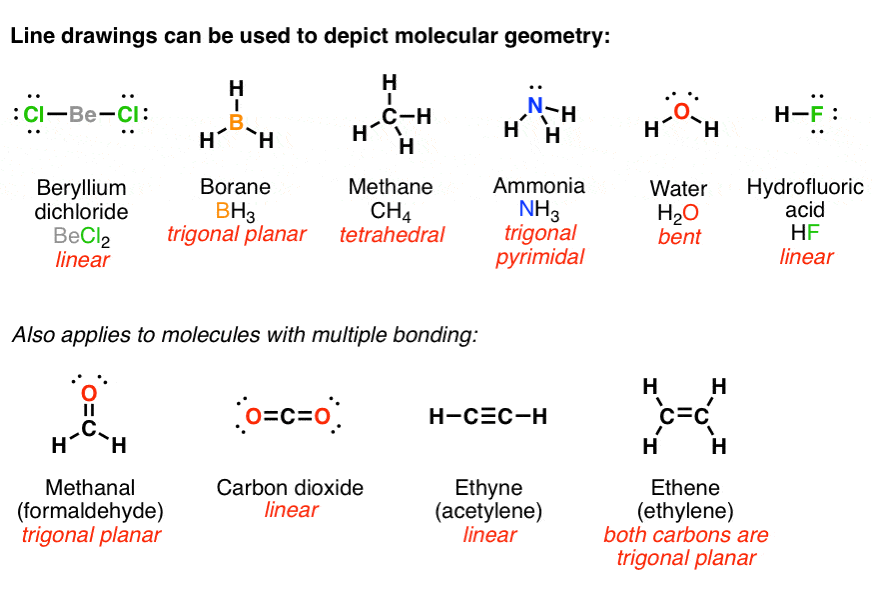
این ما را به نکته دوم می رساند. جفتهای الکترون دفع میکنند – این هم برای پیوند الکترونها و هم الکترونها در جفتهای تک صدق میکند. بنابراین مولکول ها هندسه ای را اتخاذ می کنند که فاصله بین آنها را به حداکثر می رساند. به همین دلیل است که متان چهار وجهی است، (زوایای داخلی 109 درجه) و مربع مسطح نیست (زوایای داخلی 90 درجه)، و آب خمیده است، نه خطی. ممکن است به یاد داشته باشید که به آن VSEPR (دفعه جفت الکترون لایه ظرفیتی) گفته می شود.
ترسیم هندسه مولکولی با استفاده از لوئیس کامل، طراحی بسیار درهم و برهم را ایجاد می کند. به همین دلیل است که ما لوئیس کامل را برای نیم لوئیس رها می کنیم، خطوط را به اطراف حرکت می دهیم و فقط جفت الکترون ها را داخل می گذاریم.
اکنون حتی یک ردیف دوم تنبلی وجود دارد. کار کمتری است که فقط کشیدن جفت الکترون ها را به طور کلی رها کنید. این رایج ترین روشی است که مولکول ها کشیده می شوند. بیایید به چند نمونه نگاه کنیم.
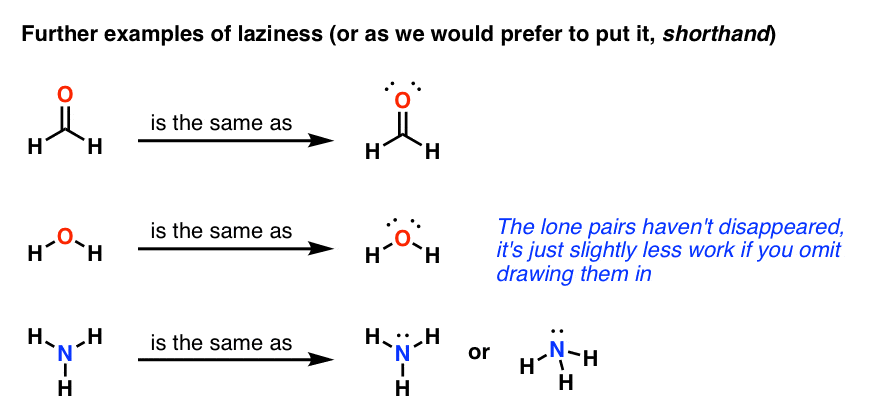
شما باید بدانید که جفت های تنها هنوز آنجا هستند، حتی اگر به داخل کشیده نشده باشند. آنها را مانند مجسمه های چوب شیمیایی در نظر بگیرید. برای مثال، xkcd تمایلی به کشیدن صورت، پا یا دست ندارد، اما این بدان معنا نیست که شخصیتهایی که ترسیم میکند به طور ضمنی قطع شده بدون صورت هستند. کشیدن شکل های چوبی سریع تر است.این مهم است زیرا در شیمی آلی، جفت های تنها اغلب فقط دور هم نمی نشینند. همانطور که بعداً خواهید دید، جفت های تنها هسته دوست هستند – آنها در مجموعه ای از واکنش های شیمیایی شرکت می کنند. بنابراین بسیار مهم است که بدانید آنها آنجا هستند، حتی اگر جذب نشده باشند.
پست بعدی – از ژنرال شیمی تا شیمی آلی، قسمت 8 – پیوند یونی و کووالانسی
