ساختارهای تشدید با بار مثبت: چهار اصل کلیدی
همانطور که قبلاً اشاره کردم، شکل(های) رزونانسی با کمترین انرژی آنهایی هستند که در آنها بارها به حداقل می رسد. با این حال، گاهی اوقات شما نمی توانید آن را دور بزنید: باید شارژ کنید جایی. آخرین بار در مورد اصول مربوط به تصمیم گیری در مورد بهترین مکان برای قرار دادن بار منفی صحبت کردم: روی حداقل اتم پایه. امروز در مورد وضعیت مخالف صحبت خواهم کرد: جایی که یک بار مثبت قرار دهیم.
1. اتم های فاقد الکترون توسط همسایگان غنی از الکترون تثبیت می شوند
هنگام تصمیم گیری در مورد اینکه کدام سایت بار مثبت را به بهترین شکل تثبیت می کند، واقعاً یک اصل اصلی وجود دارد که باید به آن فکر کنید. خلاصه یک جمله ای از شیمی را به یاد بیاورید: بارهای مخالف جذب می شوند، مانند بارها دفع می شوند. اتم های فقیر از الکترون توسط اتم های غنی از الکترون مجاور تثبیت می شوند. اتم های فقیر الکترون هستند بی ثبات شده است توسط اتم های فقیر از الکترون
به طور دقیق تر، سه روش اصلی برای ارزیابی ساختارهای تشدید وجود دارد.

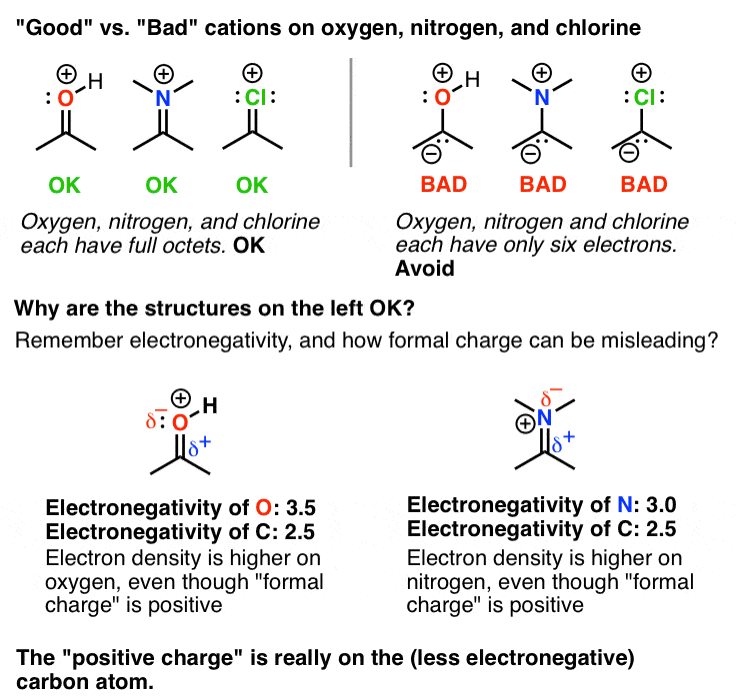
احتمالاً این اولین اصل است که بیش از همه باعث سردرگمی می شود. بیایید به فرم های “بهترین” و “دومین بهترین” تشدید برای این گونه های دارای بار مثبت نگاه کنیم. توجه کنید که چگونه در هر یک، دومین شکل رزونانسی دارای کربوکاتیون است – یعنی a کربن با شش الکترون ظرفیتی بهترین فرم رزونانس جدید است π پیوندی که از طریق اهدای یک جفت الکترون بر روی اتم مجاور (O، N، Cl، F) ایجاد شده است. در این فرآیند ما یک بار مثبت روی آن اتم می گذاریم.
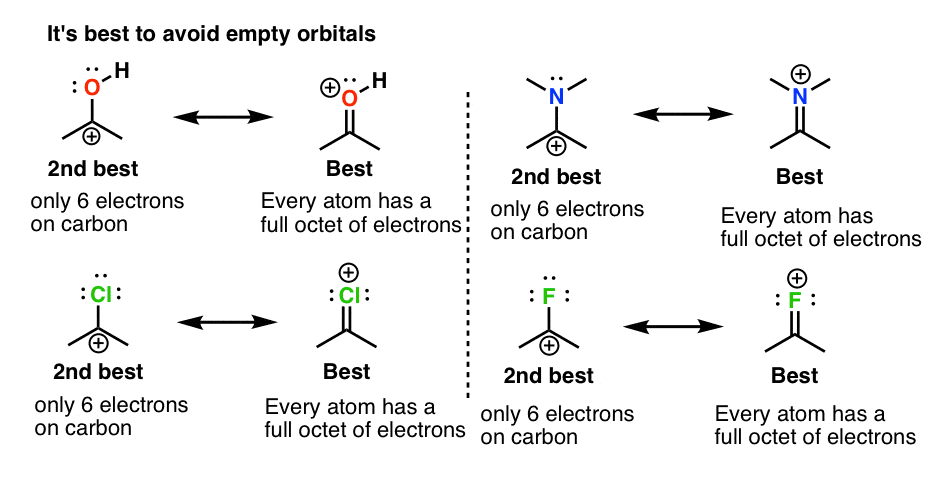
2. شارژهای رسمی مثبت بر روی اکسیژن یا نیتروژن تا زمانی که یک Octet کامل داشته باشد خوب است
چرا این عجیب است؟ زیرا تا این مرحله، احتمالاً عادت کرده اید که اتم هایی مانند F، O، Cl و N را به عنوان «الکترون اسکروج» جدول تناوبی در نظر بگیرید. به دلیل الکترونگاتیوی بالای خود، الکترون ها را از هر چیزی که به آن متصل هستند، دور می کنند. در اینجا یک مفهوم جدید مهم است: وقتی اتم هایی با یک جفت تنها مجاور اتمی با اوربیتال خالی باشند، یک π باند مورد لطف قرار خواهد گرفت. یادت باشد تشکیل یک پیوند شیمیایی یک رویداد کاهش دهنده انرژی است. “از دست دادن” یک جفت کامل تنها در اتم اهدا کننده بیش از انرژی آزاد شده از طریق تشکیل یک اتم جدید جبران می شود. π پیوند به اوربیتال خالی
ما به این می گوییم π اهدا این مفهوم بسیار مهمی است که در پست بعدی چیزهای بیشتری در مورد آن گفته می شود، اما اگر می خواهید موضوعات را در اینجا انسان سازی کنید، می توانید F، O، N و Cl را با اسکروج های معروفی مانند جان دی راکفلر، اندرو کارنگی مقایسه کنید. و حتی بیل گیتس: در حالی که ممکن است آنها را حریص تصور می کردند، اما جنبه بشردوستانه نیز دارند.
فقط یک نکته قابل توجه است: اگرچه ممکن است “بد” به نظر برسد که یک بار مثبت بر روی اتم های الکترومنفی مانند O، N، Cl و F قرار دهید، اما در این موارد خوب است زیرا اگر از نزدیک نگاه کنید یک هشت عدد کامل الکترون وجود دارد. روی هر یک از این اتم ها به یاد بیاورید که “بار مثبت” ما در واقع است اتهام رسمی، و این را به خاطر بسپارید بار رسمی همیشه چگالی الکترون را منعکس نمی کند. بنابراین در این موارد این اتم ها در واقع کمبود الکترون ندارند.
با این حال، مهم است که بین این نوع اتمهای دارای بار مثبت و آنهایی که در نمودار زیر یک اکتت کامل ندارند، تمایز قائل شویم. برای اتم هایی مانند F، O و N از نظر انرژی بسیار نامطلوب است که کمتر از یک هشت عدد کامل الکترون داشته باشند. اجتناب کردن!
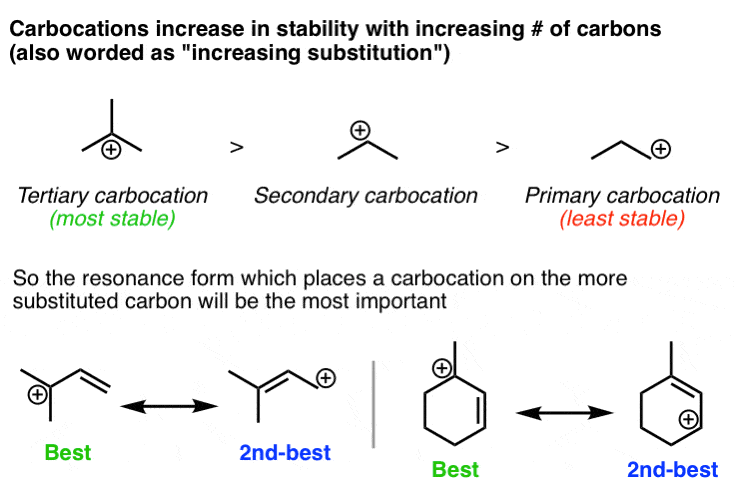
3. هنگام قرار دادن بارهای مثبت بر روی کربن، شکل تشدید که در آن بار مثبت روی کربن جایگزین شده است، مهم ترین خواهد بود.
در اینجا دومین اصل مهم در مورد تثبیت بار مثبت مطرح می شود: در صورت امکان، بهترین کار این است که بار مثبت را روی اتم کربنی که بیشترین جایگزینی را دارد قرار دهید. همانطور که اغلب به دانش آموزانم می گویم، “اگر شما فقیر هستید، داشتن همسایگان ثروتمند کمک می کند”. پایداری کربوکاتیون ها با تعداد گروه های آلکیل متصل افزایش می یابد. مرور 3 عاملی که کربوکاتیون ها را تثبیت می کنند ممکن است مفید باشد.
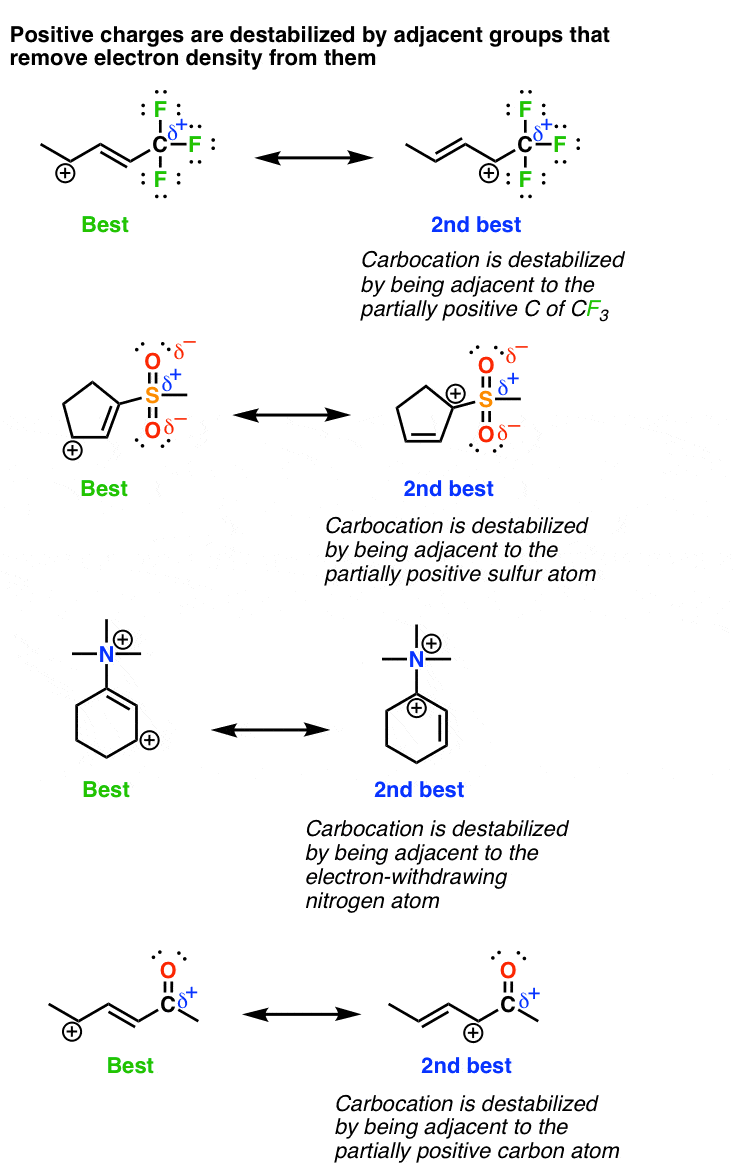
4. کربوکاتیونها توسط گروههای خارجکننده الکترون مجاور که فاقد جفتهای تنها هستند (مانند CF) بیثبات میشوند.3، NR3+ و C=O)
آخرین عاملی که باید در نظر داشت، اساساً معکوس چیزی است که اکنون در مورد آن بحث کردیم. کربوکاتیون ها هستند بی ثبات شده است در مجاورت گروه های الکترون گیر اکنون مهم است که اخطار را اضافه کنیم – گروه های خارج کننده الکترون که نمی توانند یک جفت تنها اهدا کنند. بنابراین می توانیم گروه هایی مانند CF را قرار دهیم3، NR3,(+) COOR, COOH, SO3H، نه2، و سایرین در این دسته. بیایید نگاهی بیندازیم. توجه داشته باشید که در هر مورد کربوکاتیون به گروهی متصل است که چگالی الکترون را از آن حذف می کند *بدون* اینکه قادر به اهدای یک جفت الکترون تنها باشد. باز هم ممکن است مفید باشد که 3 عامل را مرور کنیم بی ثبات کردن کربوکاتیون ها
بنابراین امیدواریم که (بیشتر) مقدمه ای برای ارزیابی پایداری اشکال مختلف تشدید را پوشش دهد. در چند پست بعدی، نحوه اعمال رزونانس برای یافتن مکانهای واکنشی روی یک مولکول را شروع خواهیم کرد.
پست بعدی: اعمال رزونانس (1): اهدای پی