چرا آلکیلاسیون آمین ها (معروف به «سنتز اتر ویلیامسون، اما برای آمین ها») معمولاً انجام نمی شود
روندها در پایه آمین ها یک مثال کلاسیک از اینکه چرا شیمی بسیار جالب است ارائه می دهد. این رمزگشایی از مبادلات ظریف بین عوامل کلی مختلف در موارد خاص است که به شیمیدانان سر و صدایی می دهد. معجزه شروع به آشکار شدن می کند.
– تابع موج کنجکاو (Ash Jogalekar)
باشه مردم امروز بیایید در مورد نحوه ساخت آمین صحبت کنیم. آنقدرها هم که فکر می کنید ساده نیست.
فهرست مطالب
- “سنتز ویلیامسون اتر، اما برای آمین ها”: چرا این واکنش بد است؟
- قطار فراری از آلکیلاسیون آمین، مرحله 1: Sن2
- مرحله 2: آلکیلاسیون توسط یک واکنش اسید-باز دنبال می شود…
- … آزادسازی یک آمین که هسته دوست بهتری است: مرحله 3: یک SN2 دوم
- مرحله 4: یک واکنش اسید-باز دیگر یک هسته دوست حتی بهتر می سازد
- قطار فراری ادامه دارد
- واکنش تمایل به توقف در آمین های سوم دارد. معمولا.
- خلاصه: آلکیلاسیون آمین ها به طور کلی مکیده است. در اینجا چند راه حل وجود دارد
- یادداشت ها، به علاوه “متیلاسیون کامل”
- (پیشرفته) مراجع و مطالعه بیشتر
1. چرا این واکنش بد است؟
ببینید آیا می توانید جای خالی سوال تست مهارت زیر را پر کنید:
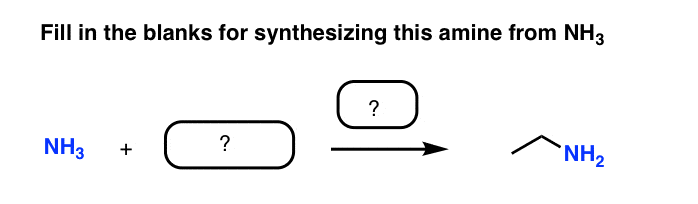
بیایید روند فکر را طی کنیم. ما باید یک پیوند CN تشکیل دهیم. N NH3 یک جفت تنها دارد و یک هسته دوست خوب است. بنابراین، بسیار شبیه سنتز اتر ویلیامسون، شاید بتوانیم از یک آلکیل هالید مانند اتیل بروماید (CH) استفاده کنیم.3CH2Br) و بوم! انجام شده.
کاملاً اینطور معلوم نمی شود. به قول دانشمندی که این موضوع را به طور کامل بررسی کرده است:
“برهمکنش اتیل بروماید و آمونیاک … تا حد زیادی منجر به تشکیل تری اتیلامین می شود.”
[ref: Werner, J. Chem. Soc. 1918, p. 899]
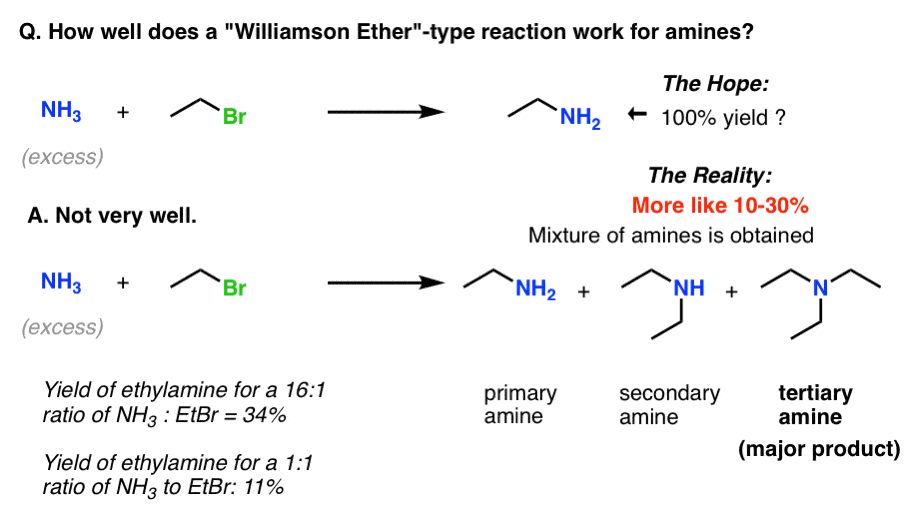
تشکیل یک آمین اولیه از طریق آلکیلاسیون آمونیاک یک واکنش بسیار بد است. (به دلایل اقتصادی، wبه طور کلی میخواهید از واکنشهایی استفاده کنید که یک محصول غالب را با بازده بالا تشکیل میدهند تا از جداسازیهای خستهکننده جلوگیری شود: این واجد شرایط نیست.)
این بخشی از سرگرمی* یادگیری شیمی آلی است. درست زمانی که فکر می کنید ممکن است چیزهایی را متوجه شده باشید، یک توپ منحنی در راه است. (*تعریف شما از “سرگرمی” ممکن است متفاوت باشد)
چرا این واکنش بد است؟
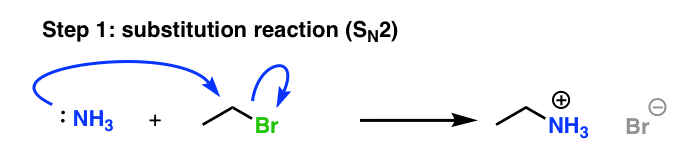
2. قطار فراری از آلکیلاسیون آمین، مرحله 1: Sن2
بیایید به اولین واکنشی که در لحظه ترکیب محلول آمونیاک با اتیل بروماید اتفاق می افتد نگاه کنیم: جایگزینی هسته دوست (از طریق Sن2 مکانیسم)
3. مرحله 2: آلکیلاسیون توسط یک واکنش اسید باز دنبال می شود
تا کنون خیلی خوب. ما پیوند CN خود را تشکیل داده ایم. از آنجایی که واکنش حاوی آمونیاک بیش از حد است، واکنش اسید-باز می تواند منجر به خنثی شدن حداقل مقداری از نمک آمونیوم شود و آمین اولیه خنثی ما را تولید کند.
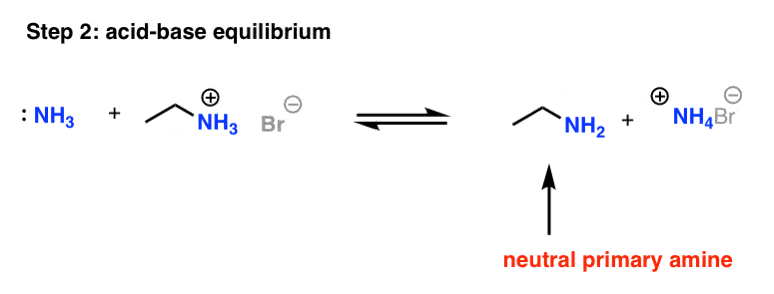
بنابراین اکنون ما آمین اولیه را داریم. کار ما تمام شد، درست است؟
نه خیلی سریع. ببینید، نسبت به واکنشهای جانشینی، واکنشهای اسید-باز سریع هستند، بنابراین این رویداد deprotonation قبل از اینکه اولین واکنش جایگزینی تمام اتیل برومید باقیمانده را مصرف کند، رخ میدهد.
این بدان معناست که اتیلامین در همان فلاسک با اتیل بروماید وجود خواهد داشت.
بنابراین؟
4. مرحله 3: واکنش اسید-باز یک هسته دوست آمین را آزاد می کند که حتی بهتر از آمین شروع کننده است.
خب، اتیلامین خودش یک نوکلئوفیل خوب است. در واقع، این یک هسته دوست حتی بهتر از خود آمونیاک است، به دلیل گروه آلکیل دهنده الکترون [Link: 5 factors that affect the basicity of amines]
چقدر بهتر؟ اگر استفاده کنیم pKآاچ به عنوان یک نماینده برای هسته دوستی (معقول است، زیرا مانع فضایی در اینجا یک عامل نیست) ما یک pK داریمآH از 10.7 برای اتیلامین در مقابل 9.2 برای NH3. یعنی حدود 101.5 = 30 برابر نوکلئوفیل تر.
اتیلامین ایجاد شده توسط اولین Sن2 به جای NH شروع به بلعیدن اتیل برومید می کند3!
ما یک هیولا ساخته ایم!
حتی اگر سعی کنیم عرشه را با (مثلا) 15 برابر مقدار NH روی هم قرار دهیم3، واکنش اتیلامین همچنان با ضریب (30/15) 2 = سریعتر خواهد بود. [That’s what Werner did, above; the yield of EtNH2 was 34% under those conditions, versus 11% for just 1 equiv of NH3.]
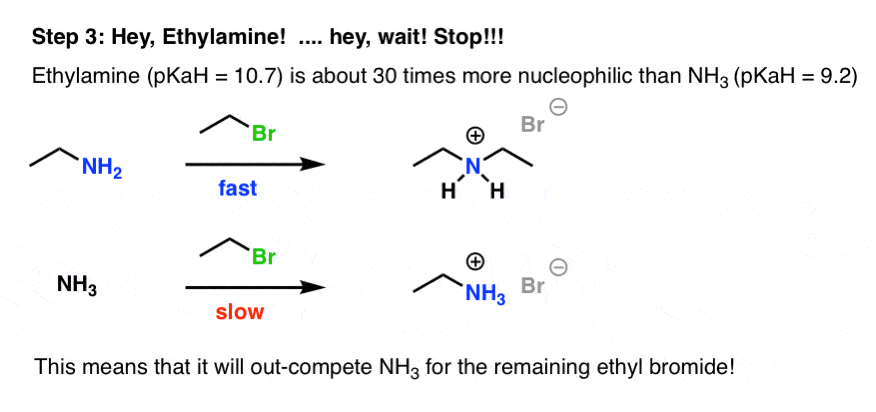
5. مرحله 4: یک واکنش اسید-باز دیگر یک نوکلئوفیل حتی بهتر می سازد
اکنون محصول دی اتیل آمونیوم را در حضور باز اضافی داریم که حداقل منجر به تشکیل دی اتیل آمین می شود.
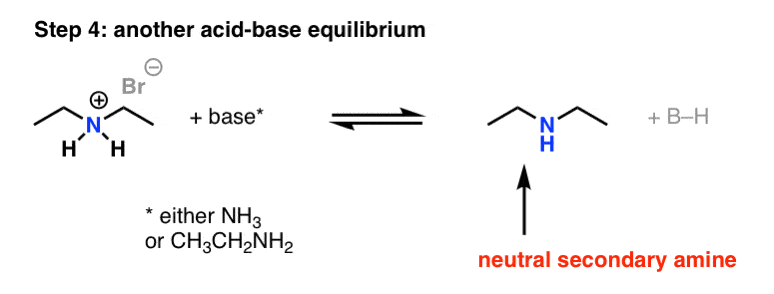
میدونی یعنی چی؟ یک هسته دوست دیگر تولید شده است که با NH رقابت خواهد کرد3 برای اتیل بروماید باقی مانده
چگونه هسته دوستی با آمونیاک و اتیلامین مقایسه می شود؟
pKآH از دی اتیل آمین حدود 11.0 است، که آن را کمی هسته دوست تر از اتیلامین می کند!
6. قطار فراری ادامه دارد
دی اتیل آمین که یک هسته دوست قوی تر از آمونیاک و اتیلامین است، با اتیل برومید باقی مانده سریعتر از هر یک از این دو گونه واکنش نشان می دهد. این باعث تشکیل تری اتیل آمونیوم برومید می شود که سپس می تواند پروتونه شود (با استفاده از هر یک از بازهای آمین در محلول) تا تری اتیل آمین خنثی را تشکیل دهد.
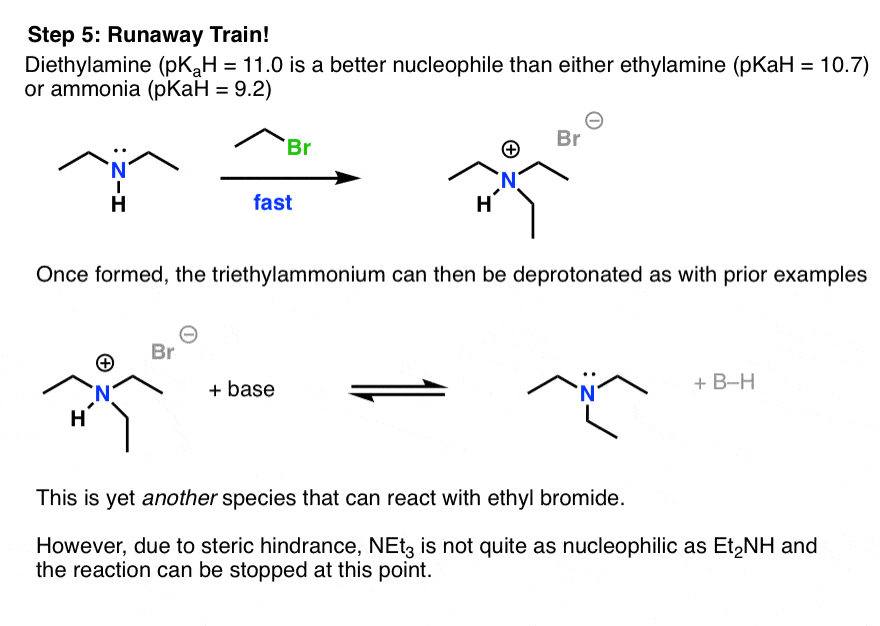
اکنون داریم سه گونههای آمین نوکلئوفیل همگی به طور همزمان در محلول شنا میکنند، قبل از اینکه تمام اتیل برومید ما مصرف شود.
این سوپ حاوی چندین محصول آمین نوع واکنشی است که دوست من جف در دفترچه آزمایشگاهی خود به عنوان “BFM” توصیف می کند. (“B” برای “بزرگ” و “M” برای “به هم ریختگی” است…)
7. واکنش تمایل به توقف در آمین های سوم دارد…
“قطار فراری” معمولاً در مرحله آمین سوم متوقف می شود. در این مورد خاص، pKآH تری اتیلامین 10.75 است که کمی کمتر از دی اتیلامین است. [Recall that pKaH refers to basicity, not nucleophilicity: the basicity of NEt3 is attenuated here due to the lowered solubility of the conjugate acid in water. [more here]. ]هسته دوستی تری اتیل آمین کمتر از دی اتیل آمین است تا حد زیادی به این دلیل که نیتروژن تری اتیلامین درجه سوم است که باعث افزایش مانع فضایی و کاهش سرعت واکنش می شود.
به همین دلیل، تشکیل آمین های ثالث از آمین های ثانویه از طریق آلکیلاسیون، در بیشتر موارد، از بیانیه گسترده ما “آمین آلکیلاسیون تلخ است” مستثنی است.
8. خلاصه: آلکیلاسیون آمین ها به طور کلی مکش می کند. در اینجا چند راه حل وجود دارد
در غیر این صورت باید از راه حل استفاده کرد. مقدار زیادی وجود دارد. برای مثال آزیدها نوکلئوفیل های خوبی هستند و می توان آنها را بدون حادثه آلکیله کرد و سپس به آمین تبدیل کرد. سنتز گابریل یک راه حل دیگر است.
در مورد سوال تست مهارت ما از بالای مقاله چطور؟
در اینجا واکنشی وجود دارد که اکثر شیمیدانان آلی آن را بهترین راه عمومی برای ساخت آمین می دانند: واکنشی به نام آمیناسیون تقلیل دهنده
در اینجا یک پیش نمایش دزدکی حرکت کردن است.
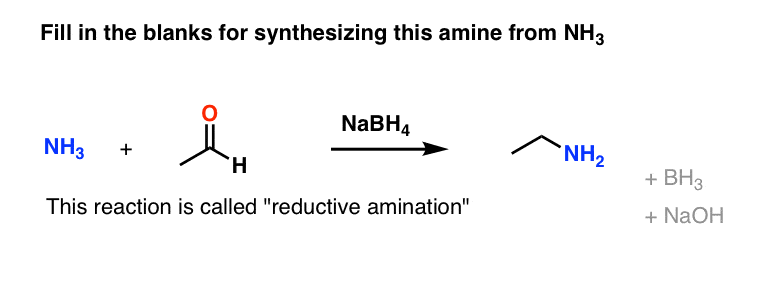
دفعه بعد در مورد نحوه عملکرد این واکنش صحبت خواهیم کرد.
پست بعدی: آمیناسیون تقلیل دهنده
یادداشت
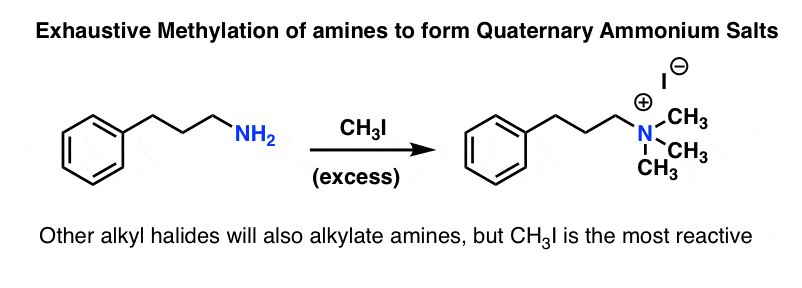
آلکیلاسیون می تواند به دادن نمک های آمونیوم کواترنری در “متیلاسیون کامل” ادامه دهد.
پاورقی. دیدیم که آلکیلاسیون آمونیاک بیشتر در مرحله آمین سوم متوقف شد.
اگرچه آمین های سوم تمایل به هسته دوستی کمتری نسبت به آمین های ثانویه دارند، اما همچنان هسته دوست هستند و هنگامی که با آلکیل هالید اضافی تحت شرایط اجباری درمان شوند، می توانند به نمک های آمونیوم چهارتایی تبدیل شوند.
بهترین مثال در مورد متیل یدید است، در واکنشی به نام متیلاسیون جامع به یاد بیاورید که متیل هالیدها سریع ترین الکیل هالیدها در S هستندن2 واکنش به دلیل مانع فضایی کم آنها.
درمان آمین ها با مقدار زیادی متیل یدید منجر به نمک های آمونیوم چهارتایی آنها می شود. همانطور که در پست آینده خواهیم دید، این نمک های آمونیوم چهارتایی می توانند به عنوان گروه های ترک عالی در واکنش های حذف (و به ندرت واکنش های جایگزینی) برای تولید آلکن ها، به ویژه در حذف هافمن، رفتار کنند.
ویرایش کنید. هوم سعی کردم “قطار فراری” را جاسازی کنم اما کار نکرد.
(پیشرفته) مراجع و مطالعه بیشتر
- – تهیه اتیلامین و دی اتیلامین
امیل آلفونس ورنر
جی. شیمی. Soc. ترانس. 1918، 113، 899-902
DOI: 10.1039/CT9181300899
گزارش اولیه در مورد سنتز آلکیل آمین ها با آلکیلاسیون آمونیاک با اتیل بروماید، و پاراگراف دوم با ” شروع می شود.این یک روش معیوب است، زیرا تا حد زیادی منجر به تشکیل تری اتیلامین کمتر مفید و در نتیجه از دست دادن بازده پایه های اولیه و ثانویه می شود.“. - اثر سزیم: انتخاب شیمیایی بالا در N-آلکیلاسیون مستقیم آمین ها
رالف نیکلاس سالواتوره، ادویت اس. ناگل و کیونگ وون جونگ
مجله شیمی آلی 2002، 67 (3)، 674-683
DOI: 1021/jo010643c
منوآلکیلاسیون انتخابی آمین ها امکان پذیر است، مشروط بر اینکه بدانید چگونه. - N-آلکیلاسیون کارآمد و انتخابی آمین ها با الکل های کاتالیز شده توسط کمپلکس های گیره منگنز
ساراواناکومار الانگوان، یاکوب نویمان، ژان باپتیست سورتایس، کاترین جونگ، کریستوف دارسل و ماتیاس بلر
ارتباطات طبیعت 2016، 7:12641
DOI: 10.1038/ncomms12641 - سنتز انتخابی آمین های ثانویه و ثالثی با N-آلکیلاسیون احیا کننده نیتریل ها و N-آلکیلاسیون آمین ها و فرمات آمونیوم کاتالیز شده توسط کمپلکس روتنیوم
Iryna D. Alshakova، دکتر Georgii I. Nikonov
ChemCatChem 2019، 11 (21)، 5370-5378
DOI: 10.1002/cctc.201900561
هر دو مقاله اساساً در یک واکنش هستند. مکانیسم این واکنش ها نشان می دهد که اساسا یک آمیناسیون تقلیل دهنده “یک گلدان” است. الکل در محل اکسید می شود و الکل اضافی به عنوان یک احیا کننده عمل می کند. - N-آلکیلاسیون آبی آمین ها با استفاده از آلکیل هالیدها: تولید مستقیم آمین های سوم تحت تابش مایکروویو
یوهونگ جوا و راجندر اس. وارما
شیمی سبز، 2004، 6، 219-221
DOI: 10.1039/B401620C
این مقاله نشان میدهد که آلکیلاسیون آمینهای ثانویه، بدیهی است که آمینهای سوم را تولید میکند. اما مهمتر از آن، نمک های آمونیوم چهارتایی تنها به سختی تشکیل می شوند. این مقاله هیچ گونه تشکیل نمک آمونیوم چهارتایی را حتی پس از حرارت دادن طولانی مدت یک آمین ثانویه در مایکروویو با آلکیل هالید اضافی گزارش نمی کند.
