تعریف ترکیب آلی فلزی چیست؟
- در بسیاری از گروه های عاملی در شیمی آلی، کربن به عنصر الکترونگاتیو تری متصل می شود که به آن یک بار مثبت جزئی و ویژگی الکتروفیل می دهد.
- با این حال، وقتی کربن به یک عنصر الکترونگاتیو کمتر – به ویژه فلزات – متصل شود، دارای یک عنصر جزئی خواهد بود. منفی باردار و دارای ویژگی هسته دوست است
- مولکول هایی که حاوی پیوند کربن و فلز هستند به عنوان شناخته می شوند آلی فلزی ترکیبات
- نمونههایی از ترکیبات آلی فلزی شامل ترکیبات آلی لیتیوم، ترکیبات ارگانومیزیمی (معرفهای گریگنارد) و ارگانوکوپراتها (معرفهای گیلمن) است.

فهرست مطالب
- تجدید نظر در “دوقطبی”
- دوقطبی ها سرنخی برای واکنش پذیری ارائه می دهند
- چند نمونه از چگونگی کنترل دوقطبی ها بر واکنش پذیری
- آلی فلزات: حاوی پیوندهای کربن و فلز (و دارای کربن های هسته دوست!)
- خلاصه: آلی فلزی
- یادداشت
1. برخی از پیشینه در دوقطبی
دست کم گرفتن اهمیت آن سخت است دوقطبی ها در تعیین واکنش پذیری یک مولکول هستند.
صبر کن: دوقطبی ها، ممکن است بپرسید. اچچگونه یک دوقطبی را دوباره تعیین کنیم؟
بیایید این مجموعه را با اطمینان از روشن بودن این موضوع شروع کنیم، زیرا برای درک کلاسی از مولکولهایی که آنها را “ارگانومتالیک” مینامیم، کلیدی خواهد بود.
به یاد بیاورید که مولکول ها از پیوندهای کووالانسی بین اتم ها ساخته شده اند، اما الکترون های موجود در پیوندهای کووالانسی همیشه به طور مساوی بین اتم ها تقسیم نمی شوند.
- زمانی که دو اتم با الکترونگاتیوی متفاوت یک پیوند کووالانسی تشکیل میدهند، اتمی با الکترونگاتیوی بالاتر (اگر انسانسازی را ببخشید، برای الکترونها حریصتر است) سهم نامساوی از آن الکترونها خواهد داشت که منجر به تجمع نسبی بار منفی در آن میشود. آن اتم (که ما با استفاده از نماد δ نشان می دهیم– ).
- برعکس، اتمی با منفی کمتری، کسری جزئی از چگالی الکترون خواهد داشت که منجر به بار مثبت جزئی می شود (δ+).
- محتملترین مکان برای یافتن یک دوقطبی بزرگ، جستجوی اتمهای الکترونگاتیو قوی مانند اکسیژن (3.5) و نیتروژن (3.0) یا هالوژنهای فلوراید (4.0)، کلر (3.2) و برم (3.0) است: اگر هر یک از این اتمها وجود داشته باشد. به یک اتم الکترونگاتیو کمتر مانند کربن (2.6) یا هیدروژن (2.2) متصل می شود، یک دوقطبی ایجاد می شود.

از آنجا که بارهای مخالف جذب می شوند، اتم هایی که غنی از الکترون هستند (δ– ) جذب اتم هایی می شوند که بار مثبت جزئی دارند (δ+).
احتمالا قبلاً آن را دیده اید مولکول هایی با دوقطبی های بزرگ (موسوم به مولکول های “قطبی”) تمایل دارند بالاتر نقاط جوش و نقطه ذوب نسبت به مولکول هایی با وزن مولکولی مشابه بدون آنها (مولکول های “غیر قطبی”).
دلیل آن این است که برهمکنشهای جذاب بین دوقطبیهای دارای بار مخالف (مثلاً پیوندهای هیدروژنی و برهمکنشهای دوقطبی-دوقطبی) برای ایجاد اختلال نیاز به انرژی اضافی دارند.
2. پیشینه بیشتر: استفاده از دوقطبی ها برای درک سایت های واکنشی
یکی دیگر از ویژگیهای دوقطبیها که کمتر به آن اشاره میشود، این است که آنها فرضیههای بسیار خوبی را برای تعیین محل وقوع واکنشها بین دو مولکول معین در اختیار ما قرار میدهند.
اگر شروع به پوشش حتی سادهترین واکنشها کردهاید، قبلاً یاد گرفتهاید که پیوندها زمانی تشکیل میشوند که یک پایه لوئیس (غنی از الکترون) یک جفت الکترون را به اسید لوئیس (الکترون ضعیف) ببخشد.
- هنگامی که جفت الکترون به هر اتمی به جز هیدروژن اهدا می شود، ما معمولاً آن باز لوئیس را “هسته دوست” می نامیم. [when a lone pair is being donated to hydrogen, we tend to call it a “base”].
- از آنجایی که هسته های اتمی دارای بار مثبت هستند، “هسته دوست” مخفف “دوست داشتن بار مثبت” است. هیچ چیز جدیدی در اینجا وجود ندارد: اتم هایی که (δ– ) به اتم هایی جذب می شوند که (δ+).
از سوی دیگر، از آنجایی که اسیدهای لوئیس تمایل به الکترونی ضعیف دارند (δ+، بار منفی دوست دارند) و جذب الکترون می شوند [or to be more specific, atoms with high electron density (δ– ) ]، ما اغلب اسیدهای لوئیس را “الکتروفیل” می نامیم.
برای کوتاه کردن آن به یک نقطه، تقریباً هر واکنشی که یاد میگیرید نسخهای از نوکلئوفیل (بار منفی) است که به الکتروفیل (بار مثبت) حمله میکند.. و یادگیری تشخیص دوقطبی به شما کمک می کند تا هسته دوست ها و الکتروفیل ها را بشناسید.
این نمودار سعی می کند برخی از تعاملات بین هسته دوست های بالقوه و الکتروفیل ها را تنها بر اساس دوقطبی ها نشان دهد. توجه داشته باشید که این به این معنی نیست که واکنشهای بین این اتمها لزوما رخ خواهد داد – فقط میگویند که اینها حدسهای خوبی برای اینکه «عمل» کجا خواهد بود، هستند.
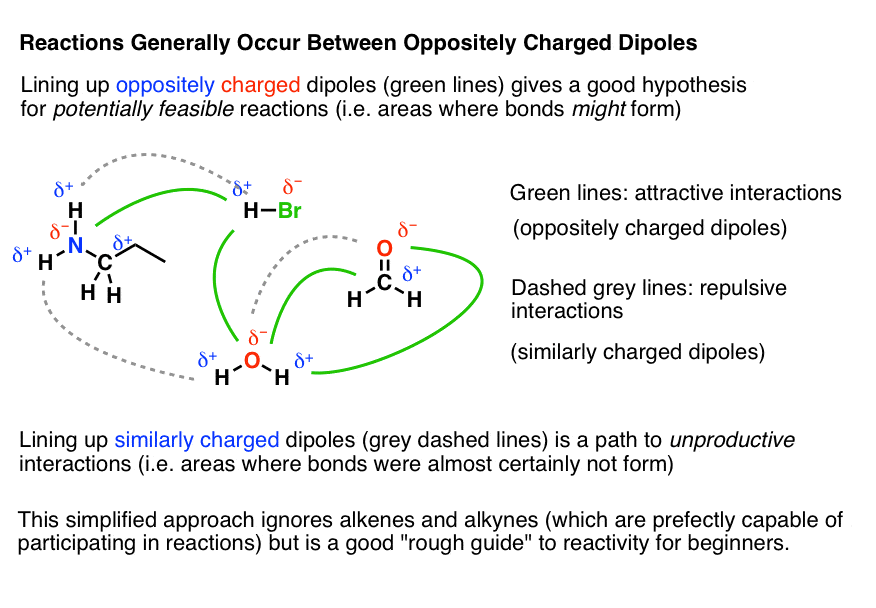
3. مثال هایی با واکنش ها
فقط برای نشان دادن، در اینجا چند نمونه از واقعی واکنش ها در Org 1 (یا گاهی اوقات Org 2) می بینید که از این الگو پیروی می کنند. توجه داشته باشید که چگونه منبع الکترون (دم فلش آبی – هسته دوست) همیشه است منفی انتهای یک دوقطبی، و گیرنده الکترون (سر فلش آبی – الکتروفیل) همیشه مثبت انتهای یک دوقطبی نوکلئوفیل به الکتروفیل حمله می کند.
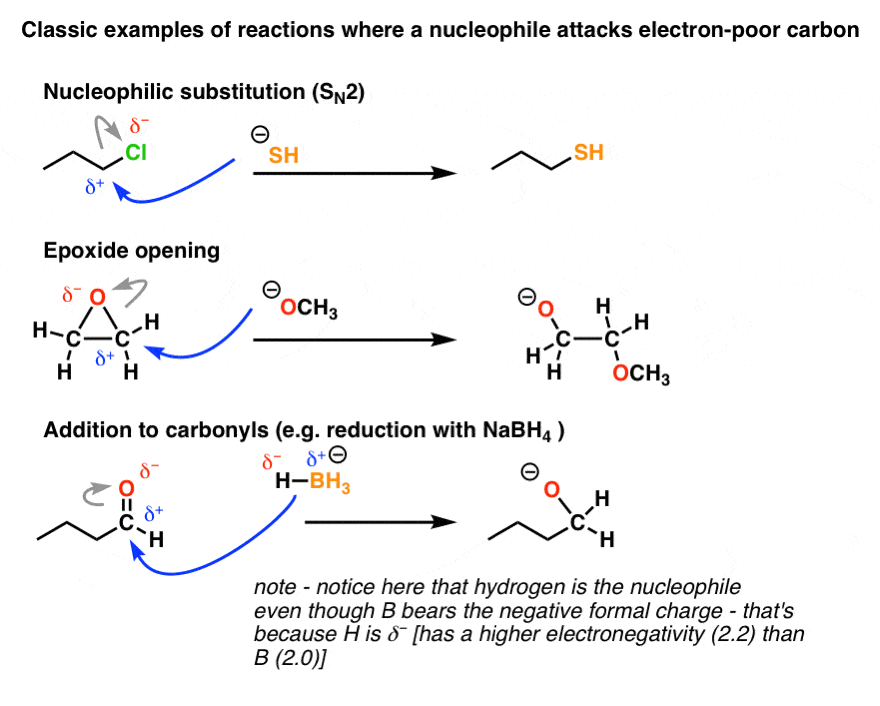
یک ترفند وجود دارد – نمونه آخر را ببینید؟ بور بار رسمی منفی دارد (BH4–) اما هیدروژن به عنوان یک هسته دوست عمل می کند. اونجا چه خبره؟
در اینجا، ترفند این است که ببینیم هیدروژن در واقع الکترونگاتیوی بالاتری (2.2) نسبت به بور (2.0) دارد و بنابراین در پیوند BH، این هیدروژن است که δ است.– . همیشه بیشتر از هزینه رسمی به دوقطبی توجه کنید، زیرا اتهام رسمی می تواند گمراه کننده باشد.
4. آلی فلزی مولکول هایی هستند که دارای پیوند کربن و فلز هستند
همه اینها باید بررسی شود. با این حال، مانند سگی که قبل از اینکه بالاخره دراز بکشد باید دور بالش راه برود، گاهی معلمان باید قبل از ورود به یک موضوع، مقدمه را از سر راه خود حذف کنند.
دلیل شروع من با دوقطبی ها به شرح زیر است. اکثر گروه های عاملی که در شیمی آلی با آنها روبرو خواهید شد یک ویژگی مشترک دارند. به دنبال بزرگترین دوقطبی در این گروه های عملکردی باشید.
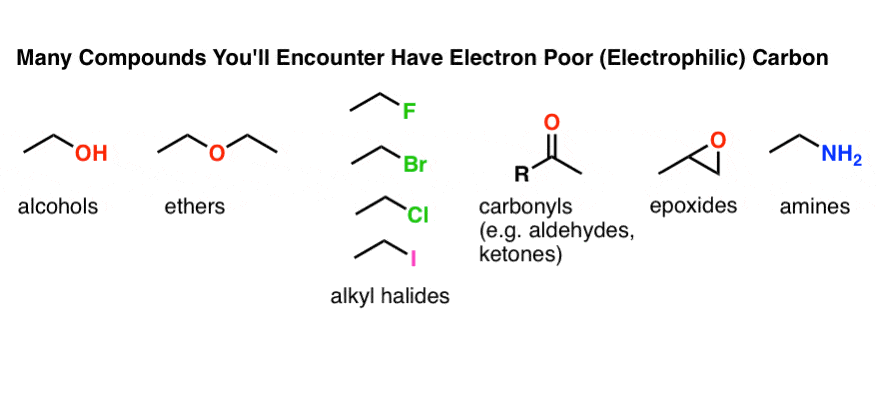
آیا توجه دارید که در تمام این موارد، کربن الکترو مثبت است [electron poor]? ما کربن را به عنوان یک الکتروفیل می بینیم بنابراین اغلب در شیمی آلی مقدماتی، مهم است که بدانیم کربن می تواند به عنوان یک عمل کند هسته دوست همچنین.
اگر کربن وقتی به گروه الکترونگاتیوتری متصل میشود، تمایل به الکتروفیل دارد، در چه شرایطی کربن میتواند به عنوان یک هسته دوست عمل کند؟
وقتی به یک اتم الکترونگاتیو کمتر متصل است! به هر حال، کربن از نظر الکترونگاتیوی کمی از طبقه متوسط بالاست (2.6). بسیاری از عناصر دیگر در جدول تناوبی با الکترونگاتیو کمتر از آن وجود دارد. بسیاری از آنها هستند فلزات از انواع مختلف، خواه فلزات قلیایی، فلزات قلیایی خاکی یا فلزات واسطه باشند. حتی عناصر گروه 13 (گروه III قدیمی) – بور، آلومینیوم و غیره – به عنوان فلز برای این اهداف واجد شرایط هستند.
به مولکول هایی که حاوی پیوند کربن و فلز هستند، گفته می شود آلی فلزی.

موضوع رایج در شیمی آلی فلزی این است که کربن تمایل دارد به عنوان یک هسته دوست عمل کند (یا یک باز، اگر اسیدهای برونستد در اطراف وجود داشته باشد).
در پستهای بعدی به نمونههایی از واکنشها خواهیم پرداخت، اما ابتدا اجازه دهید نمونههایی از ظاهر ترکیبات آلی فلزی را ببینیم. سه مورد از آنها در شیمی آلی مقدماتی بسیار رایج هستند. ترکیبات ارگانولیتیوم، ترکیبات آلی منیزیم (که به نام «معرفهای گریگنارد» به نام کاشفشان نامیده میشوند)، و معرفهای آلی (معمولاً پس از شیمیدانی که اولین بار آنها را رایج کرد، معرفهای «گیلمن» نامیده میشوند. هنری گیلمن از دانشگاه ایالتی آیووا).

5. خلاصه: ترکیبات آلی فلزی
البته وجود دارد زیاد نمونه های بیشتری از ترکیبات آلی فلزی – این فقط گرد و غبار برف روی نوک کوه یخ است – اما برای اهداف ما، این سه دسته از ترکیبات آلی فلزی بیشتر بار را حمل خواهند کرد.
در پست بعدی چند نمونه از آن را نشان خواهیم داد چگونه این ترکیبات آلی فلزی ساخته می شوند.
یادداشت
یادداشت 1. این سری فقط به سطحی ترین جنبه های ترکیبات آلی فلزی و واکنش های آنها می پردازد. برای درمان بسیار دقیق تر، شدیداً شما را تشویق می کنم که مراجعه کنید خواننده آلی فلزی توسط مایک ایوانز، یک منبع آنلاین رایگان که اصول این موضوع بسیار عمیق را آموزش می دهد.
