تمرینات تمرینی معطر در مقابل ضد آروماتیک در مقابل غیر معطر
آخرین پست ما در این مجموعه در مورد معطر بودن، از 4 شرطی که یک مولکول برای معطر بودن باید داشته باشد، گذشت.
- اولین، باید چرخه ای باشد
- دومین، هر اتم در اطراف حلقه باید یک اوربیتال p در دسترس داشته باشد
- سومتعداد الکترون های سیستم پی باید 2، 6، 10، 14، 18 یا یک عدد بیشتر در مجموعه باشد که از 18 با افزایش 4 (22، 26، 30… و غیره) افزایش می یابد. ما معمولاً این را مخفف می کنیم [4n+2] الکترون پین
- چهارم، مولکول باید صاف باشد.
در آن پست سعی کردیم معنی هر یک از این قوانین را توضیح دهیم – بنابراین اگر هر یک از این موارد برای شما نامشخص است، ممکن است ایده خوبی باشد که به آن پست بازگردید.
در این پست، ما قصد داریم این 4 قانون را با چند مثال تمرینی اعمال کنیم.
فهرست مطالب
- سیستمی برای تعیین معطر بودن مولکول ها: یک جدول بسازید
- بنزن
- آنیون بنزن
- کاتیون سیکلوپنتادین
- پیرول
- اسید مزدوج پیرول
- پیریدین
- تیوفن
- سیکلوبوتادین
- سیکلوبوتن دی آنیون
- نفتالین
- یون پیریلیم
- ایندول
- آزولن
- خلاصه: تمرینات تمرینی معطر
- یادداشت
1. سیستمی برای تعیین آروماتیک بودن مولکول ها: یک جدول بسازید
در اینجا راهنمایی من برای کسانی از شما است که سعی در پاسخ به این سوال “آیا این معطر است؟” . یک میز درست کنید.
جداول برای سازماندهی اطلاعات عالی هستند. آنها همچنین به عنوان یک چک لیست داخلی عمل می کنند.
به عنوان مثال، در اینجا تصویری از یک جلسه تدریس خصوصی با یک دانش آموز انجام دادم که در آن مشخص کردیم که آیا چندین مولکول معطر هستند یا خیر:
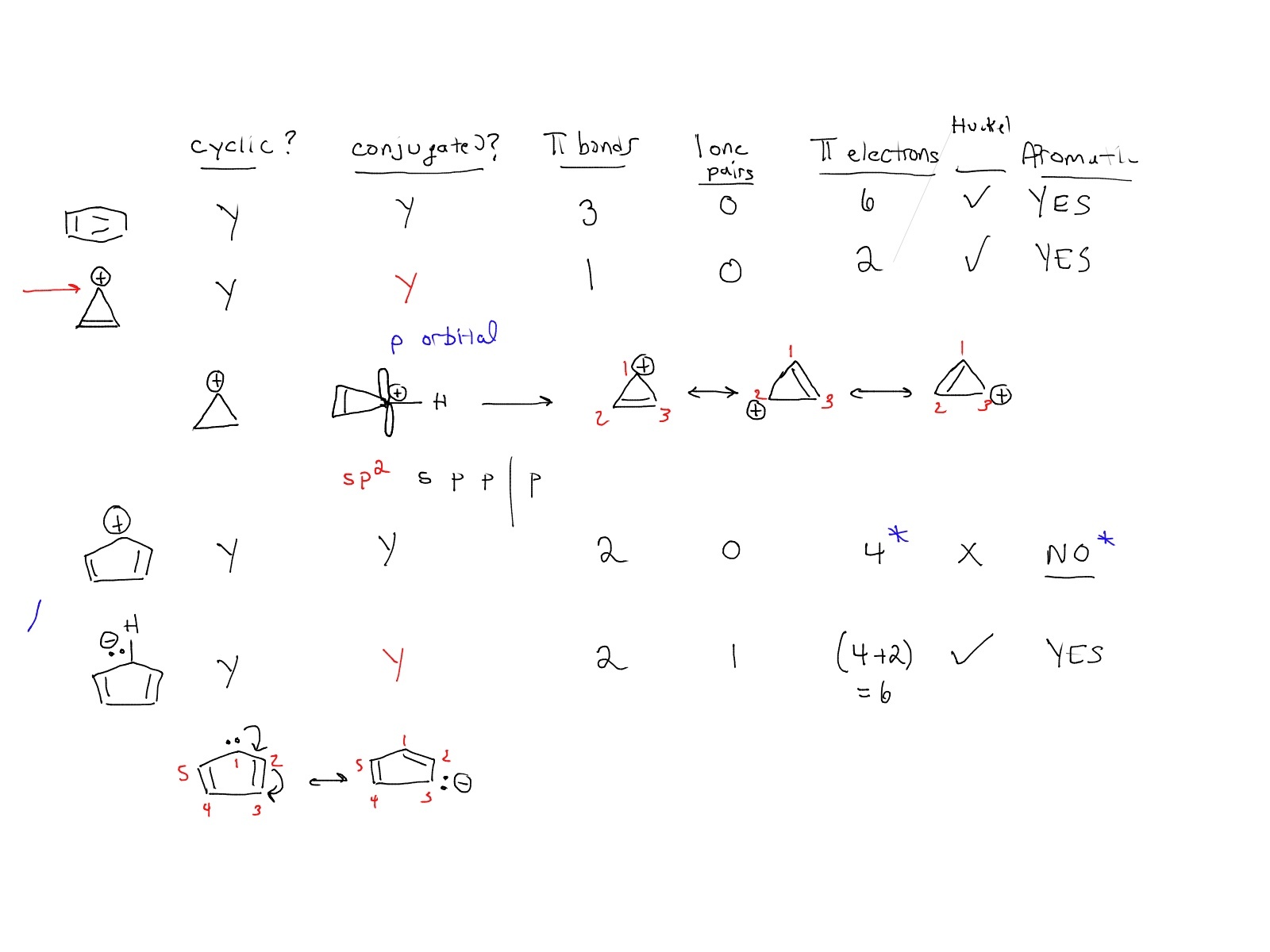
متوجه خواهید شد که چک لیست من معمولاً داشتن ستونی برای “صاف بودن” را اذیت نمی کند زیرا معمولاً فرض می شود. (شما باید چند استثناء را بدانید – دفعه قبل آن را پوشش دادیم).
امروز، 13 مولکول زیر را بررسی می کنیم و سعی می کنیم مشخص کنیم که آیا آنها معطر هستند یا خیر:
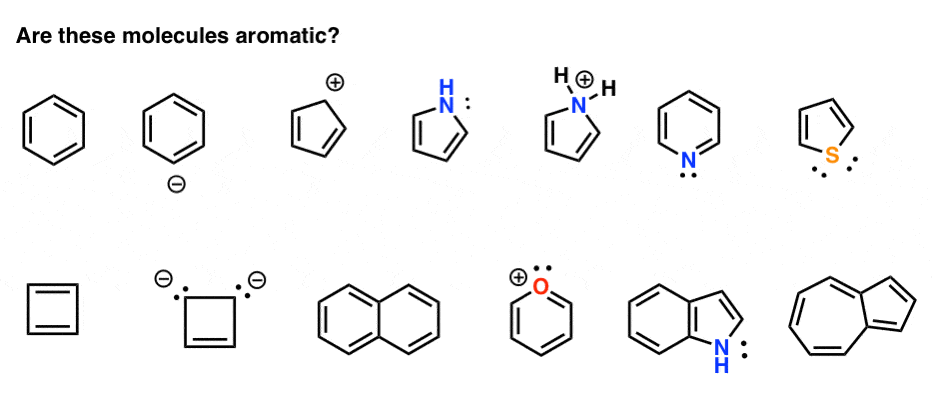
بیا شروع کنیم!
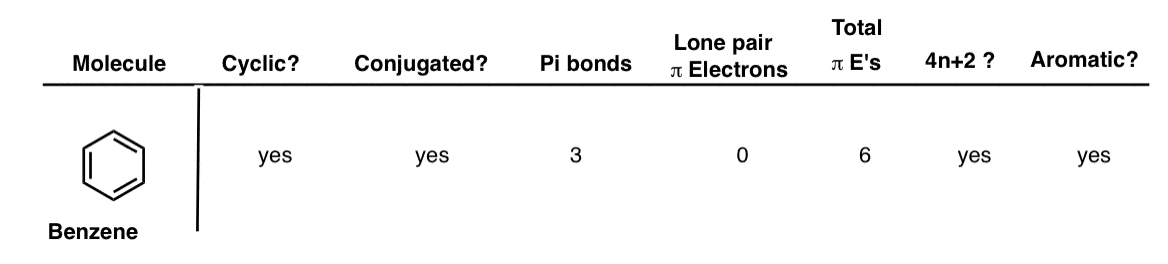
2. بنزن
ساده ترین مثال برای شروع، بنزن است و نحوه استفاده از جدول را نشان می دهد. چرخه ای، مزدوج، دارای 3 پیوند پی است و آن پیوندهای پی همگی در سیستم پی هستند. هیچ جفت تکی ندارد که به معطر بودن کمک می کند. بنابراین دارای (3 × 2) + 0 = 6 الکترون پی است. ما فرض می کنیم که صاف است (هستند). با علامت زدن تمام جعبه ها، می توان گفت که معطر است.
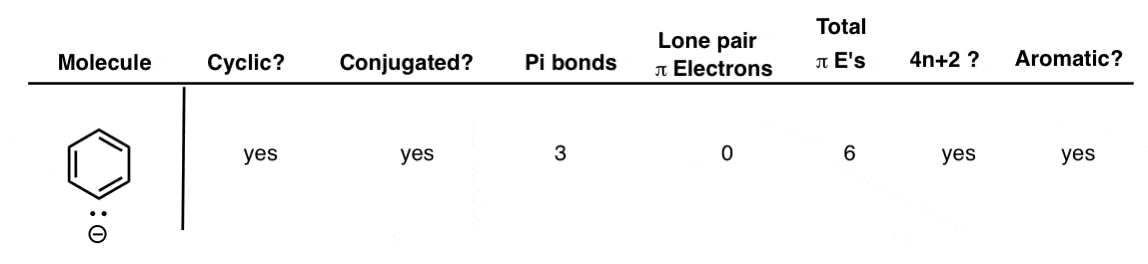
3. آنیون بنزن
اگر یک پروتون را از بنزن جدا کنید، به آن می رسید آنیون بنزن مانند بنزن، حلقوی، مزدوج، دارای 3 پیوند پی است و آن پیوندهای پی همگی در سیستم پی هستند. وسوسه انگیز است که به آن جفت تنها نگاه کنیم و فکر کنیم که ممکن است در سیستم پی نیز نقش داشته باشد و در مجموع 8 الکترون پی بدهد. با این حال، آن جفت تنها در سطح از مولکول (همراه با سایر پیوندهای CH) و بنابراین نمی تواند با اوربیتال های p همپوشانی داشته باشد. بنابراین، برای تعیین معطر بودن، می توانیم جفت تنها را نادیده بگیریم.
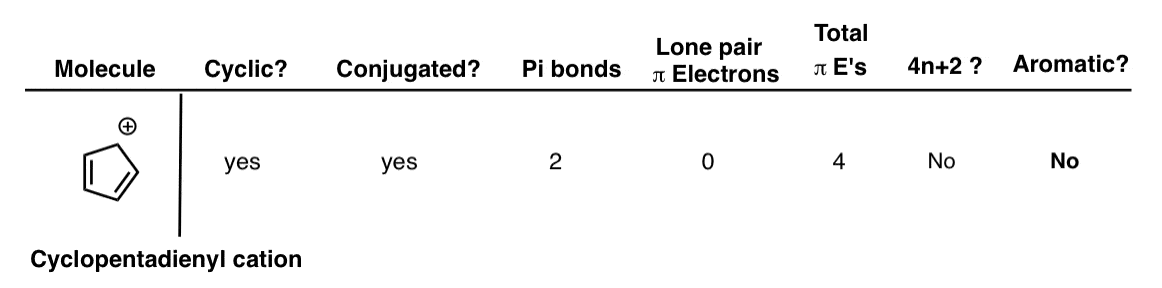
4. کاتیون سیکلوپنتادین
کاتیون سیکلوپنتادین زیر حلقوی و مزدوج است (این بار مثبت نشان دهنده کربوکاتیون با اوربیتال p خالی است). دو پیوند پی و جفت صفر تنها برای کمک به سیستم پی وجود دارد. این به ما 4 الکترون کل پی می دهد که این است نه یک شماره هوکل بنابراین معطر نیست. [Note 1]
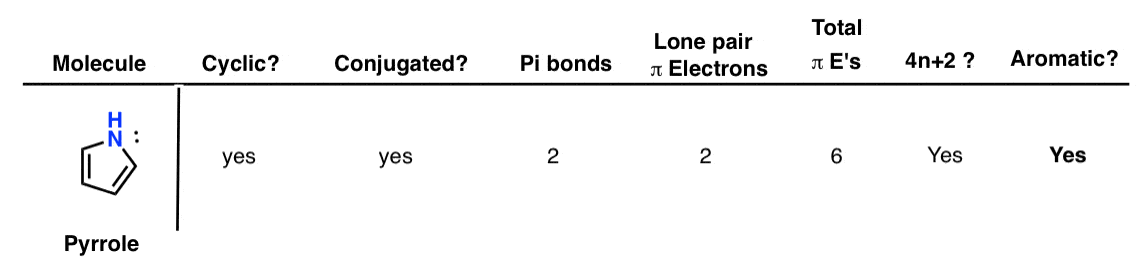
5. پیرول
پیرول حلقوی و مزدوج است (آن جفت تنها روی نیتروژن می تواند به سیستم پی کمک کند). دو پیوند پی و یک جفت تک الکترون وجود دارد که به سیستم پی کمک می کنند. این به ما 6 الکترون پی کل می دهد که یک عدد هاکل است (یعنی 4n+2 را برآورده می کند). بنابراین معطر است.
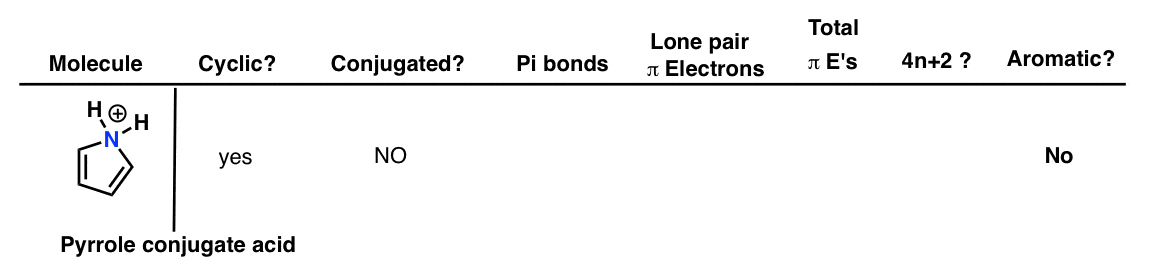
6. اسید مزدوج پیرول
اگر پیرول روی نیتروژن پروتونه شود، جفت تنها دیگر نمی تواند در سیستم پی شرکت کند. بنابراین مولکول ترسیم شده در زیر معطر نیست.
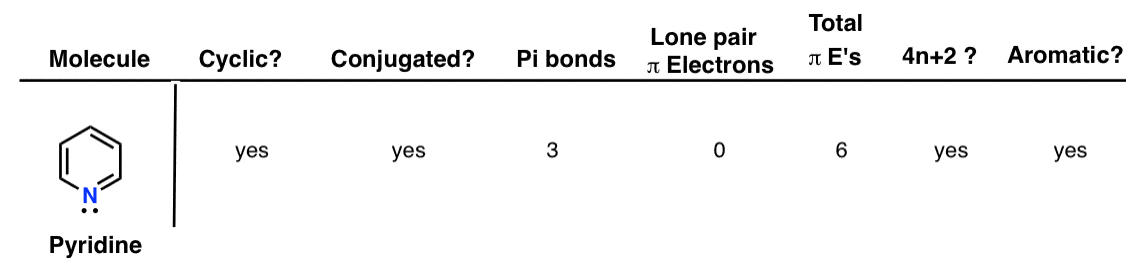
7. پیریدین
پیریدین حلقوی، مزدوج و دارای سه پیوند پی است. در آن جفت تنها شباهت زیادی به آنیون بنزن دارد به نظر می رسد مثل اینکه ممکن است به سیستم pi کمک کند، اما در واقع در صفحه حلقه است (همراه با پیوندهای CH) و بنابراین نمی تواند کمک کند (نیتروژن در حال حاضر یک اوربیتال p به سمت سیستم pi کمک می کند – توجه داشته باشید که ترسیم شده است. به عنوان شرکت در یک پیوند دوگانه با کربن مجاور). بنابراین میتوانیم جفت تنها را برای آروماتیک بودن نادیده بگیریم و در مجموع شش الکترون پی وجود دارد که یک عدد هاکل است و مولکول معطر است.
8. تیوفن
تیوفن، آنالوگ گوگرد فوران، حلقوی است و در تمام اطراف حلقه مزدوج شده است. دارای دو پیوند پی است. نکته جالب در مورد تیوفن (و فوران) این است که اگرچه یک اتم حامل دو جفت تنها در حلقه وجود دارد، ما می توانیم فقط یکی از آن جفت های تنها را به سمت سیستم پی بشمارید. [Each atom can contribute a maximum of one orbital and two electrons towards aromaticity]. جفت تنهای دیگر در صفحه حلقه قرار دارد، بسیار شبیه جفت تنها روی نیتروژن پیریدین در بالا. بنابراین تیوفن مجموعا شش الکترون پی دارد که عدد هاکل است و تیوفن معطر است.

9. سیکلوبوتادین
سیکلوبوتادین حلقوی و مزدوج است. دو پیوند پی و جفت تکی صفر وجود دارد. دو پیوند پی در مجموع 4 الکترون پی به ما می دهد که این است نه یک شماره هاکل بنابراین، درست مانند کاتیون سیکلوپنتادینیل در بالا، معطر نیست. [Note 1]
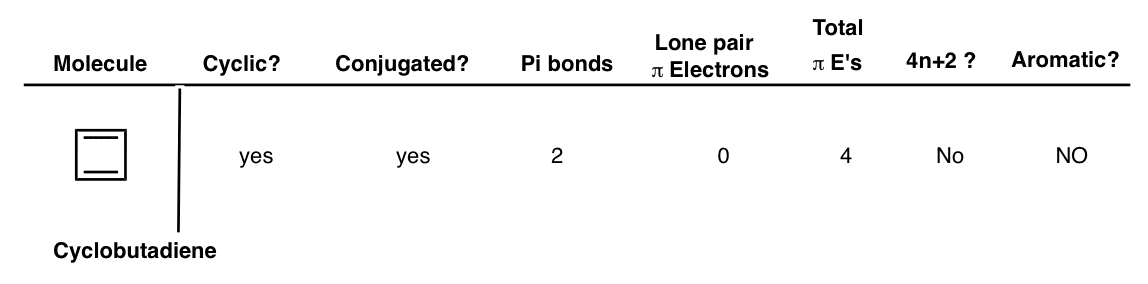
10. سیکلوبوتن دی آنیون
سیکلوبوتادین معطر نیست. با این حال، اگر به نحوی دو الکترون را به سیکلوبوتادین پمپ کنیم، وضعیت به طور قابل توجهی تغییر می کند. دیانیون سیکلوبوتادین حلقوی و مزدوج است. این یک پیوند pi منفرد دارد و اکنون دو کربن دارای جفت تک هستند که می توانند به سیستم pi کمک کنند و در مجموع شش الکترون پی به ما می دهند. این است یک عدد هاکل و بنابراین سیکلوبوتادین دی آنیون معطر است!
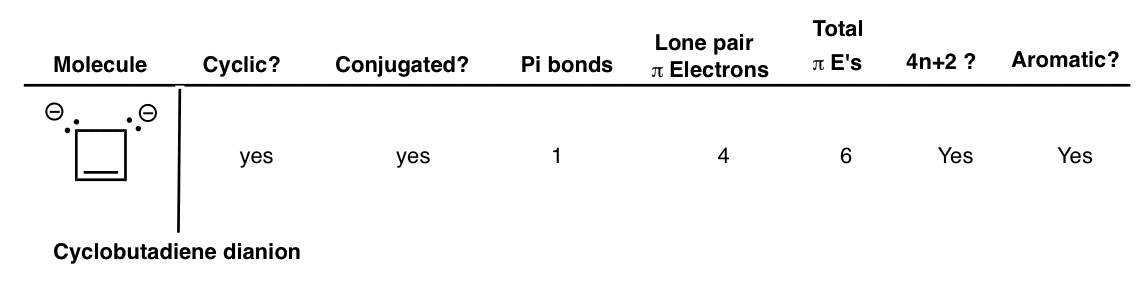
11. نفتالین
نفتالین دو حلقه دارد و بنابراین یک ترکیب دو حلقه ای است. در اطراف محیط حلقه ها مزدوج شده است و در مجموع 5 پیوند پی و زوج صفر وجود دارد که در مجموع 10 الکترون پی به ما می دهد. 10 یک عدد هاکل است (4n+2 برای n=2 راضی می کند) و نفتالین یک مولکول معطر است.
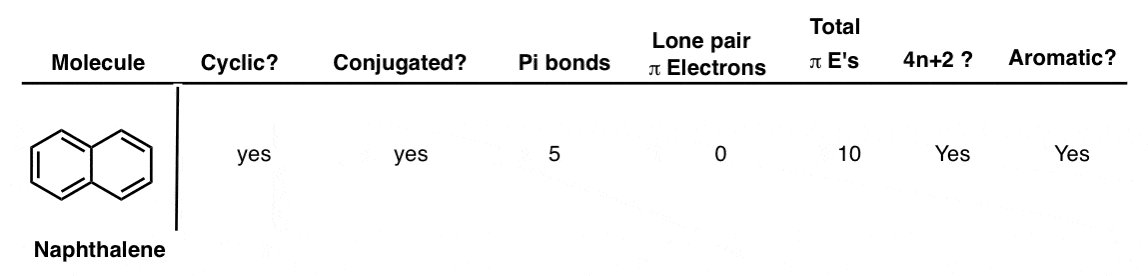
12. یون پیریلیم
یون پیریلیم یک حلقه شش عضوی است که مانند بنزن دارای سه پیوند پی است. همچنین یک جفت تنها را روی اکسیژن تحمل می کند. مانند پیریدین و آنیون بنزن، این جفت تنها در زوایای قائم به سیستم پی قرار دارد، بنابراین در واقع جزء معطر بودن آنها محسوب نمی شود. بنابراین مولکول تنها 6 الکترون در سیستم پی دارد و در واقع معطر است.
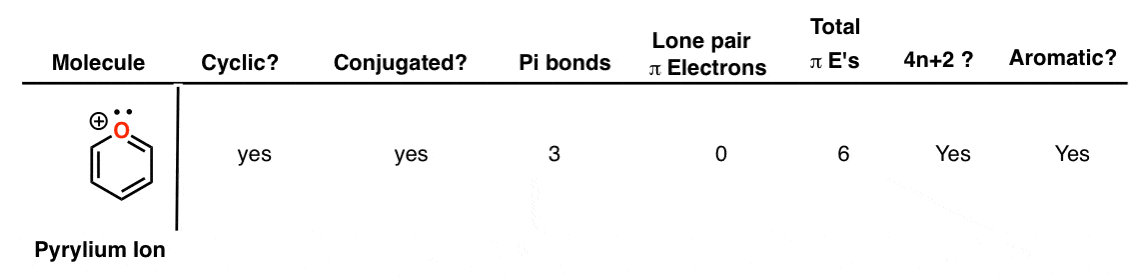
13. ایندول
ایندول یک مولکول دو سیکلی است که شبیه یک مولکول بنزن است که به یک مولکول پیرول ذوب شده است. مزدوج است؛ هر اتم در اطراف محیط دو حلقه در سیستم pi شرکت می کند. دارای 4 پیوند پی و یک جفت الکترون منفرد بر روی نیتروژنی است که در سیستم پی شرکت می کند و در مجموع 10 الکترون پی می دهد. این عدد هاکل است و ایندول در واقع معطر است.

14. آزولن
آزولن نمونه دیگری از یک مولکول دو حلقه ای است، مانند نفتالین و ایندول، در بالا. در سراسر محیط سیستم pi مزدوج شده است. پنج پیوند پی مجموع و الکترون های جفت تک صفر وجود دارد که در مجموع 10 الکترون پی را به دست می دهد که یک عدد هاکل است. و آزولن در واقع معطر است.

اگر تجسم آزولن به عنوان معطر دشوار است، ترسیم یک فرم تشدید که در آن هر دو حلقه به نظر میرسند دارای اجزای معطر هستند، ممکن است مفید باشد. به عنوان مثال، در شکل رزونانس زیر، می توانید آزولن را به عنوان متشکل از کاتیون سیکلوهپتاترین (آروماتیک) که به آنیون سیکلوپنتادین (همچنین معطر) ترکیب شده است، در نظر بگیرید.
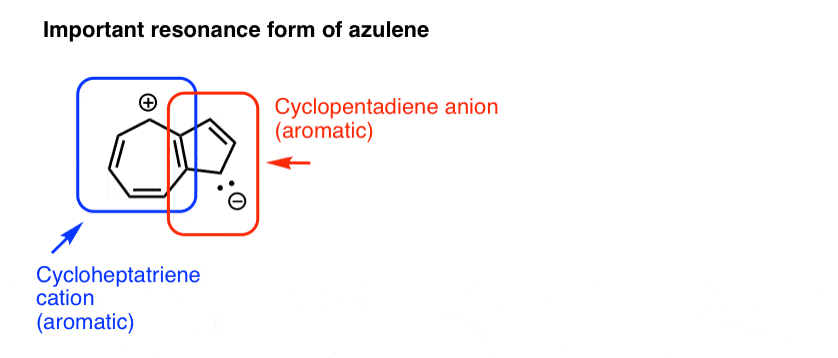
توجه داشته باشید که یک حلقه بار منفی و دیگری بار مثبت دارد. به نظر می رسد که این شکل رزونانس سهم قابل توجهی در هیبرید دارد، زیرا آزولن خود دارای یک گشتاور دوقطبی قابل توجهی است (1.08 D). در مقابل، نفتالین کاملاً فاقد ممان دوقطبی است.
15. خلاصه: تمرینات تمرینی معطر
تمام هدف استفاده از جدولی مانند جدول بالا سازماندهی افکار شماست. مانند مجموعهای از چرخهای آموزشی، اگر مشکلاتی از این قبیل را اغلب به اندازه کافی انجام دهید، متوجه میشوید که به آن نیاز ندارید.
متداولترین قسمتی که دانشآموزان دچار مشکل میشوند، شمارش تعداد الکترونهای پی است. فقط به یاد داشته باشید که هر اتم حداکثر می تواند یک اوربیتال p به سیستم pi کمک کند و اوربیتال p می تواند (حداکثر) دو الکترون پی داشته باشد.
آیا نمونه دیگری وجود دارد که در مورد آن مطمئن نیستید که باید از این سیستم استفاده کنیم؟ پیام بگذارید!
یادداشت
یادداشت 1. دو مولکول به طور خاص در لیست بالا وجود دارد که مستحق بحث بیشتر است. کاتیون سیکلوپنتادین و سیکلوبوتادین هر کدام، در بالا، به عنوان “غیر معطر” توصیف شدند، که از نظر فنی درست است.
همانطور که دیدیم بنزن در مقایسه با “سیکلوهگزاترین” نظری پایدار است، سیکلوبوتادین و کاتیون سیکلوپنتادین از این جهت جالب هستند که به طور غیرعادی ناپایدار این ملکی است به نامضد آروماتیک بودن”که در پست بعدی به تفصیل توضیح خواهیم داد.
ترکیبات ضد آروماتیک و ضد آروماتیک
با تشکر از مت استرابل برای کمک در این پست.
