همه چیز درباره گروه های کاربردی
- گروه های عاملی گروه بندی خاصی از اتم ها در داخل مولکول ها هستند که بدون توجه به سایر اتم های موجود در یک مولکول، ویژگی های مشخصه خود را دارند.
- نمونههای رایج گروههای عاملی عبارتند از الکلها، آلکنها، آلکینها، آمینها، اسیدهای کربوکسیلیک، آلدئیدها، کتونها، استرها و اترها و غیره.
- در یک دوره معمولی شیمی آلی سال دوم، حدود 15 گروه عملکردی کلیدی وجود دارد، با یک گروه دیگر 10 یا بیشتر که ظاهر ثابتی دارند. شما با دیگران نیز ملاقات خواهید کرد – این فقط گزیده ای از رایج ترین آنهاست.
1. گروه های عملکردی
یک گروه عاملی چیزی است که ما گروه بندی خاصی از اتم های خاص درون مولکول ها می نامیم که ویژگی های مشخصه خود را دارند.
در اینجا برخی از رایج ترین گروه های عملکردی وجود دارد. توجه داشته باشید که “آر” یک جایگیر برای یک جایگزین کربن عمومی است.
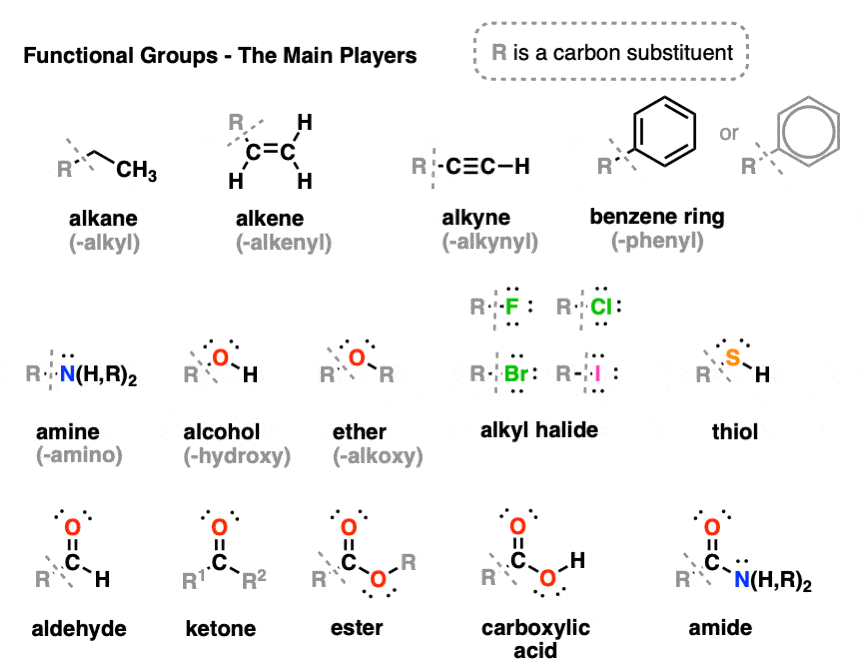
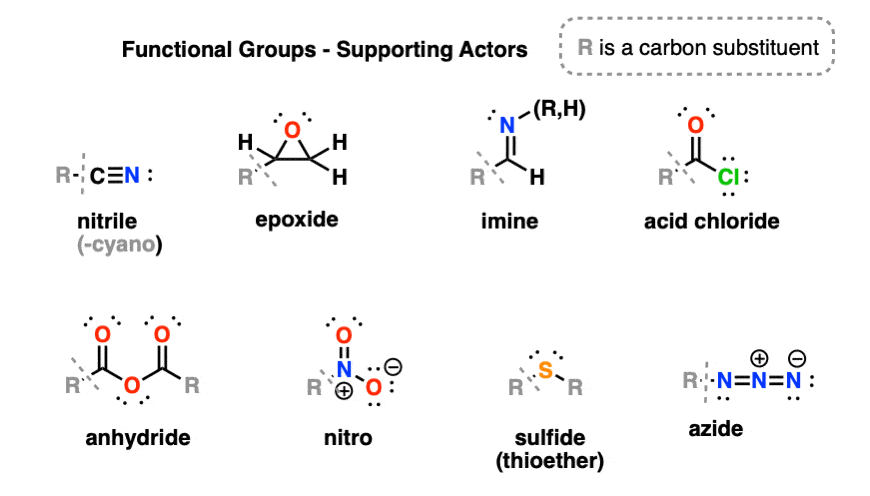
گروه دومی از گروههای عملکردی که کمی کمتر با آنها مواجه میشوند، اینجا هستند. این به هیچ وجه لیست جامعی نیست، اما حداقل شروع خوبی است.
در ابتدای دوره، ارائه لیستی از 20-25 گروه عملکردی برای به خاطر سپردن ممکن است زیاد به نظر برسد. و احتمالاً همینطور است!
خبر خوب این است که شما قبلاً تعداد زیادی نام گروه های کاربردی را بدون تلاش زیاد یاد گرفته اید.
آیا این نام ها آشنا به نظر می رسند؟
پشتیبانیآنه. تایلناول. ایبوپروفن. آزمایش کنندهیکی. دوپآمین.
یادگیری گروه های عملکردی موضوعی است که این نام ها را به ساختارهای کلی مرتبط می کند.
یکی دیگر از راه های خوب برای شناخت گروه های عملکردی، فکر کردن به خویشاوندان است الکترونگاتیوها از عناصر هر گروه این به شما کمک می کند خواص آنها را درک کنید و به شما کمک می کند در مورد نحوه رفتار آنها در واکنش های شیمیایی فکر کنید.
2. آلکان ها، آلکن ها، آلکین ها و حلقه های معطر
گروه های عاملی هیدروکربنی بسیار غیر قطبی هستند و تمایل به اسیدهای بسیار ضعیف دارند.
در هیدروکربنها، تنها انواع برهمکنشهای بین مولکولی، نیروهای پراکندگی لندن هستند و نقاط جوش آنها نسبت به مولکولهایی که گروههای عاملی قطبیتری دارند، بسیار پایین است.
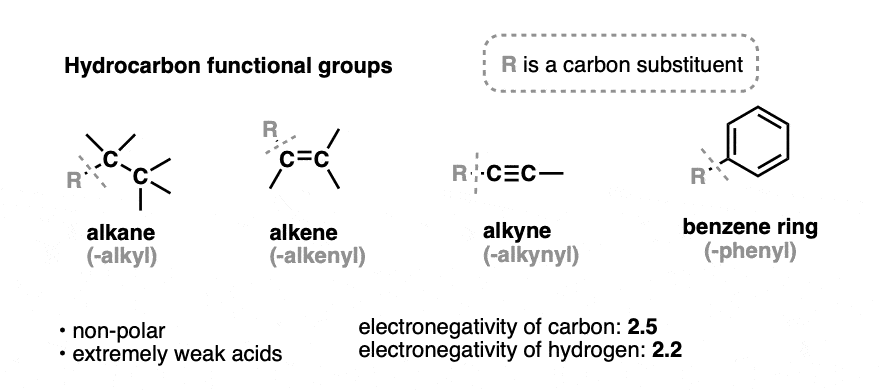
آلکان ها هیدروکربن هایی هستند که هیچ پیوند چندگانه ای ندارند. جایگزین های آلکان نامیده می شوند آلکیل گروه ها، که به آلکان های فاقد پیوند CH مانند متیل، اتیل یا پروپیل اشاره دارد.
- نمونه های رایج آلکان ها متان، اتان، پروپان، بوتان و اکتان هستند.
- پیوند CH بسیار کووالانسی است و آلکان ها بسیار غیر قطبی هستند. آنها با آب مخلوط نمی شوند.
- کربن آلکیل sp3 هیبرید شده و دارای هندسه چهار وجهی در مورد کربن هستند.
- شما اغلب می توانید گروه های آلکیل را به عنوان گروه های عاملی “تماشاگر” شیمی آلی در نظر بگیرید که به اختصار به عنوان R-. به استثنای جایگزینی رادیکال های آزاد و البته احتراق، آلکان ها تحت تعداد زیادی واکنش های مختلف قرار نمی گیرند. آنها تمایل دارند که ستون فقرات اکثر مولکول های آلی را فراهم کنند.
آلکن ها هیدروکربن هایی با یک یا چند پیوند دوگانه کربن-کربن هستند.
- نمونه های رایج اتن، پروپن و بوتن هستند.
- جایگزین های آلکن نامیده می شوند آلکنیل گروه ها؛ وینیل اغلب برای اشاره به -CH=CH استفاده می شود2 .
- کربن آلکنیل sp2 هیبرید شده، با هندسه مسطح مثلثی.
آلکین ها حاوی یک پیوند سه گانه کربن-کربن است.
حلقه های بنزن حلقه های شش عضوی حاوی 3 پیوند دوگانه است. حلقه های بنزن به دلیل خاصیتی به نام آروماتیک بودن (هیچ ارتباطی با بوی آن ندارد) در طبیعت رایج هستند که باعث پایداری غیرعادی آنها می شود. همچنین می توان به صورت شش ضلعی با دایره ترسیم کرد.
- بنزن، متیل بنزن (تولوئن) مسئول بوی چسب هواپیمای مدل است.
- جایگزین های بنزن C6اچ5– گروه های فنیل نامیده می شوند.
- کربن های موجود در بنزن sp2 هیبرید شده با هندسه مسطح مثلثی.
نمونه هایی از آلکان ها، آلکن ها، آلکین ها و حلقه های معطر را ترسیم کنید.
مولکول های زیر فاقد جانشین هستند. آنها را به داخل بکشید.
3. الکل ها، اترها، آمین ها، تیول ها، آلکیل هالیدها
این گروه های عاملی به دلیل تفاوت بیشتر در الکترونگاتیوی بین اتم های پیوند، به طور قابل توجهی قطبی تر هستند.
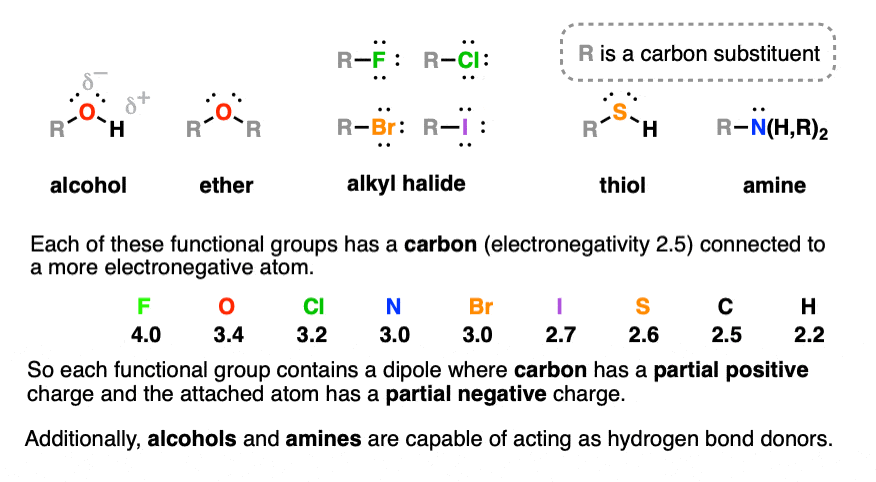
نیروهای بین مولکولی قوی تری در این گروه های عاملی به دلیل برهمکنش های دوقطبی-دوقطبی وجود دارند. علاوه بر این، الکل ها و آمین ها قادر به پیوند هیدروژنی هستند که باعث افزایش بیشتر نقطه جوش می شود.
الکل ها R-OH حاوی کربن متصل به گروه هیدروکسیل -OH است.
- نمونه های رایج عبارتند از متانول، متانول، ایزوپروپانول.
- پیوند OH بسیار قطبی است و در پیوند هیدروژنی شرکت می کند.
- گروه های هیدروکسیل نیز حلالیت در آب را افزایش می دهند.
- الکل ها اسیدهای ضعیفی هستند و می توانند به عنوان بازهای لوئیس نیز عمل کنند.
- گروه های هیدروکسیل متصل به C=O به عنوان اسیدهای کربوکسیلیک، یک گروه عملکردی جداگانه در نظر گرفته می شوند (به زیر مراجعه کنید).
اترها ROR اتمهای اکسیژن هستند که توسط دو پیوند به کربن احاطه شدهاند.
- دی اتیل اتر، تتراهیدروفوران و دی اکسان اترهایی هستند که معمولا به عنوان حلال آزمایشگاهی استفاده می شوند.
- اترها نمی توانند به عنوان اهداکننده پیوند هیدروژنی عمل کنند، بنابراین نقطه جوش آنها کمتر از الکل های با وزن مولکولی معادل است، اما بالاتر از هیدروکربن ها به دلیل نیروهای دوقطبی-دوقطبی بیشتر است.
آلکیل هالیدها دارای گروه عاملی RF، R-Cl، R-Br، RI که در آن R یک گروه آلکیل است.
- بروموبوتان، متیل بروماید و کلروفرم همگی نمونه هایی از آلکیل هالیدها هستند.
- برهمکنش های دوقطبی-دوقطبی منجر به نقاط جوش بالاتری نسبت به آلکان ها می شود.
- اگر R آلکن باشد، آنها آلکنیل هالید هستند.
- گروه های عاملی بسیار مهم برای واکنش های جایگزینی و حذفی.
آمین ها حاوی گروه عملکردی -NH است2، -NHR یا NR2 که در آن R یک هیدروکربن است.
- شکلine، کدineو کوکاine تنها سه مولکول از بسیاری از مولکول های برجسته ای هستند که حاوی آمین هستند.
- جایگزین های آمین به عنوان شناخته شده است آمینو گروه ها.
- آمین های دارای پیوند NH قادر به پیوند هیدروژنی هستند که منجر به نقاط جوش بالاتر و حلالیت در آب می شود.
- جفت تنها روی نیتروژن می تواند به عنوان پایه عمل کند.
تیول ها (مرکاپتان ها) R-SH پسر عموی الکل های حاوی گوگرد هستند.
- اتم گوگرد تقریباً به اندازه اکسیژن الکترونگاتیو نیست، بنابراین پیوند SH به طور قابل توجهی قطبش کمتری دارد.
- تیول ها می توانند به عنوان اسیدهای ضعیف عمل کنند. اسیدهای قوی تر از الکل ها
- تیول ها به دلیل بوی بدشان بدنام هستند. اتان اتیول به گاز طبیعی اضافه می شود تا بوی خاص آن را بدهد.
نمونه هایی از هر یک از این گروه های عملکردی را ترسیم کنید.
گروه های عاملی این مولکول های معروف را رسم کنید.
4. آلدهیدها، کتونها، کربوکسیلیک اسیدها، استرها
گروه C=O به گروه کربونیل گفته می شود. پیوند C=O به شدت به سمت اکسیژن قطبی شده است و کربن یک بار مثبت جزئی دارد.
کربونیل ها در آلدهیدها، کتون ها، استرها و کربوکسیلیک اسیدها یافت می شوند.
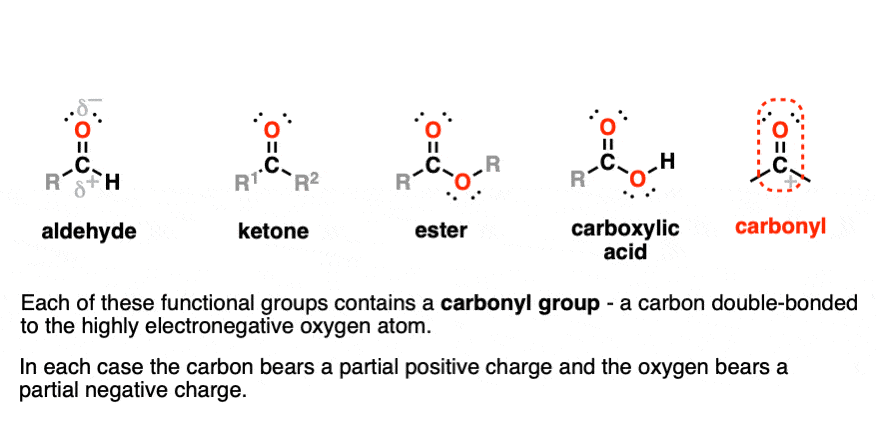
آلدهیدها RCHO دارای C=O به کربن و CH است
- فرمالدئید، استالدهید و بنزآلدئید نمونه های رایجی هستند.
- آنها پیوند کووالانسی قطبی دارند اما دهنده پیوند هیدروژنی نیستند
کتون ها RC(O)R دارای C=O به دو کربن است.
- استون (2-پروپانون) پاک کننده لاک ناخن است.
کربوکسیلیک اسیدها RCOOH دارای یک کربونیل متصل به -OH است. آنها گروه های عملکردی متمایز از الکل ها هستند.
- اسید استیک (سرکه) و اسید فرمیک ساده ترین اسیدهای کربوکسیلیک هستند. سایر اسیدهای زنجیره کوتاه مانند اسیدهای بوتانوئیک و پنتانوئیک به دلیل بوی اتاق رختکن (یا بدتر از آن) بدنام هستند.
- گروه هیدروکسیل در پیوند هیدروژنی شرکت می کند و در نتیجه اسیدهای کربوکسیلیک نقطه جوش بالاتری دارند.
- علیرغم نام، اسیدهای کربوکسیلیک اسیدهای نسبتا ضعیفی هستند که در آب تجزیه کامل نمی شوند (در مقایسه با اسیدهای قوی مانند HCl و H2بنابراین4).
استرها RCOOR شبیه اسیدهای کربوکسیلیک است، با این تفاوت که پیوند OH با پیوند OC جایگزین می شود.
- استرها به دلیل بوی شیرینشان قابل توجه هستند
- حاوی پیوندهای قطبی است، اما در پیوند هیدروژنی شرکت نمی کند.
نمونه ای از آلدهید، کتون، کربوکسیلیک اسید و استر را رسم کنید
در گروه عاملی این مولکول های برجسته رسم کنید.
5. آمیدها، اسید هالیدها، انیدریدها، نیتریل ها
در واقع چند گروه عملکردی مهم حاوی کربونیل ها وجود دارد. این گروه های عاملی همگی از اسیدهای کربوکسیلیک مشتق شده اند، زیرا می توان آنها را از طریق جایگزینی OH با گروه های مختلف به دست آورد. (نیتریل ها ممکن است در نگاه اول به اسیدهای کربوکسیلیک مرتبط نباشند، اما در واقع می توانند از طریق کم آبی به آمید تبدیل شوند.)
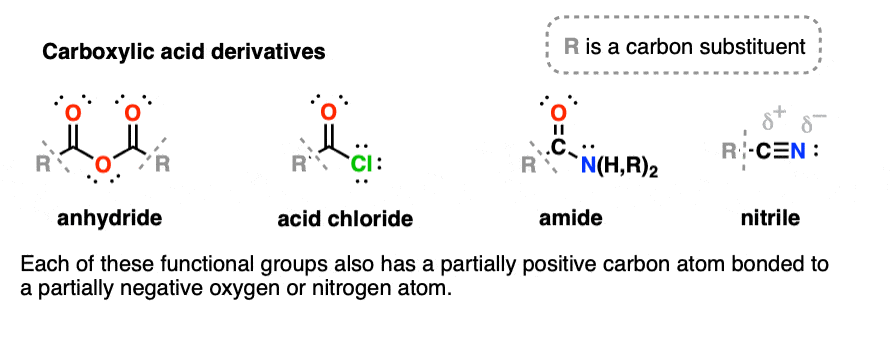
آمیدها حاوی کربن کربونیل متصل به یک گروه آمینه است.
- آمینو اسیدهایی که از طریق تشکیل یک آمید به یکدیگر متصل می شوند به عنوان پپتید شناخته می شوند.
- آمیدهای حاوی پیوند NH می توانند در پیوند هیدروژنی شرکت کنند.
هالیدهای اسیدی -OH با F، Cl، Br یا I جایگزین شده است.
انیدریدها حاوی یک اکسیژن است که توسط دو کربونیل احاطه شده است. متمایز از استرها
- انیدریدها را می توان از دو معادل یک اسید کربوکسیلیک با از دست دادن H2O تشکیل داد، از این رو این نام را به خود اختصاص داد.
نیتریل ها در ابتدا شبیه مشتقات کربوکسیلیک اسید نیستند، اما می توانند از طریق کم آبی آمیدها تشکیل شوند.
- استونیتریل یک حلال رایج است.
- “دستکش های نیتریل” از لاستیک نیتریل، یک کوپلیمری از بوتادین و اکریلونیتریل ساخته شده اند.
- جایگزین -CN گاهی اوقات به عنوان سیانید نامیده می شود.
- HCN، سیانید هیدروژن، یک گاز بسیار سمی است. یون سیانید (-)CN اغلب در دوره های مقدماتی با آن مواجه می شود (روی کاغذ، نه در آزمایشگاه!) و با آلکیل هالیدها دچار واکنش می شود.
نمونه هایی از آمید، اسید هالید، انیدرید و نیتریل را ترسیم کنید.
گروه های عاملی این مولکول های معروف را پر کنید.
6. متفرقه: اپوکسیدها، تیوترها، نیترو، ایمین، آزید
هیچ موضوع مشترکی در اینجا وجود ندارد. فقط چند گروه عملکردی برجسته دیگر که ارزش دانستن دارند.
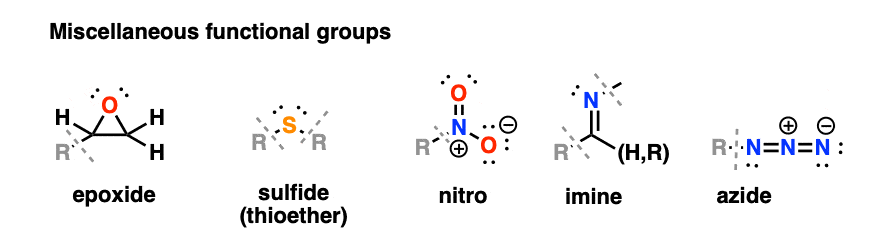
از نظر فنی، اپوکسیدها اترها هستند، اما از آنجایی که آنها در تعدادی از واکنشها شرکت میکنند که اترها معمولاً انجام نمیدهند، شایسته دستهبندی خاص خود هستند.
تیو اترها (سولفیدها) معادل گوگرد اترها هستند. دی متیل سولفید رایج ترین نمونه است.
نیترو گروه ها به شدت الکترون گیر هستند. نیترومتان، یک حلال، ساده ترین مثال از یک نیتروآلکان است.
Imines معادل های حاوی نیتروژن آلدهیدها و کتون ها هستند.
آزیدها هر از گاهی ظاهر می شود. “A” در داروی ضد HIV AZT مخفف azido است.
گروه های عاملی را در این مولکول ها رسم کنید.
7. احتمالاً در حال حاضر کافی است
البته گروه های عملکردی بیشتری وجود دارد که با آنها روبرو خواهید شد، اما این لیست باید برای اکثر دانش آموزان در یک دوره Org 1 کافی باشد. پس از گذشت یک نقطه خاص، قانون بازده کاهشی شروع به اعمال می کند.
هر چه زودتر سعی کنید از دانستن نام یک گروه عملکردی فراتر بروید و مفاهیمی مانند الکترونگاتیوی و رزونانس را به کار ببرید، هر یک از این گروه های عملکردی به نظر شما “زنده تر” خواهند بود.
یادداشت
خودت امتحان کن
(پیشرفته) مراجع و مطالعه بیشتر
- ارتباط گروه های تابعی با جدول تناوبی
جف استرویف
مجله آموزش شیمی 2009 86 (2)، 190
DOI: 10.1021/ed086p190 - یادگیری گروه های عملکردی: کلیدهای موفقیت
شانون برد و دیوید پی هیلدرث
مجله آموزش شیمی 2001 78 (10)، 1355
DOI: 10.1021/ed078p1355
