اکنون که زمان زیادی را صرف کندوکاو کرده ایم
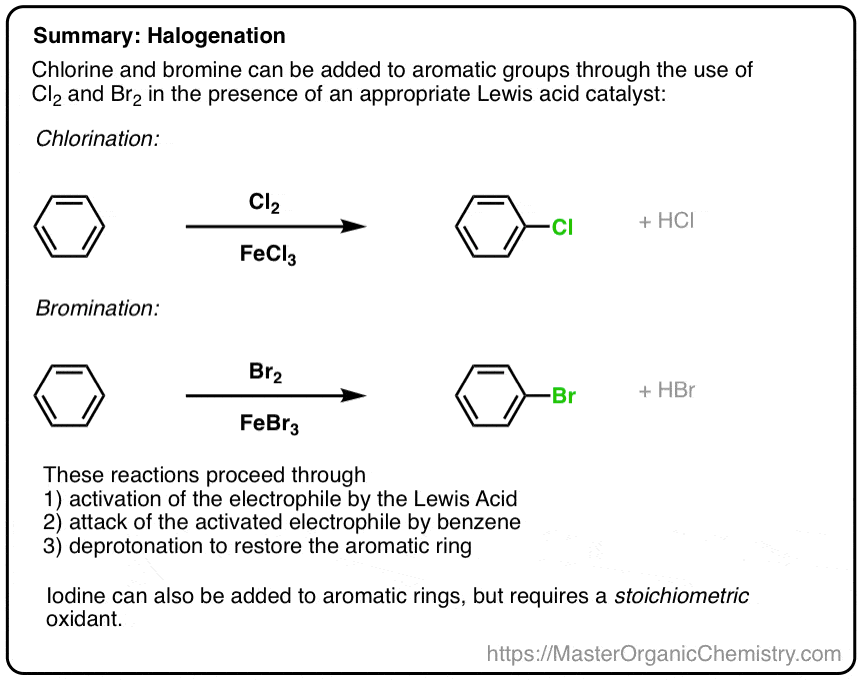
ما در نهایت آماده هستیم تا برخی از واکنش های خاص را با جزئیات بررسی کنیم. اول: هالوژناسیون. چگونه Cl، Br یا I را روی یک حلقه معطر نصب کنیم؟
[quick summary here:]
[در مورد فلوئور چطور؟ اگر F2 آنقدر جانور درنده نبود، آن را نیز درج میکردیم، اما همانطور که مطرح میشود، فلوئور بهتر است به طور غیرمستقیم به حلقههای معطر معرفی شود]
1. هالوژناسیون بنزن از طريق جایگزینی معطر الکتروفیلیک
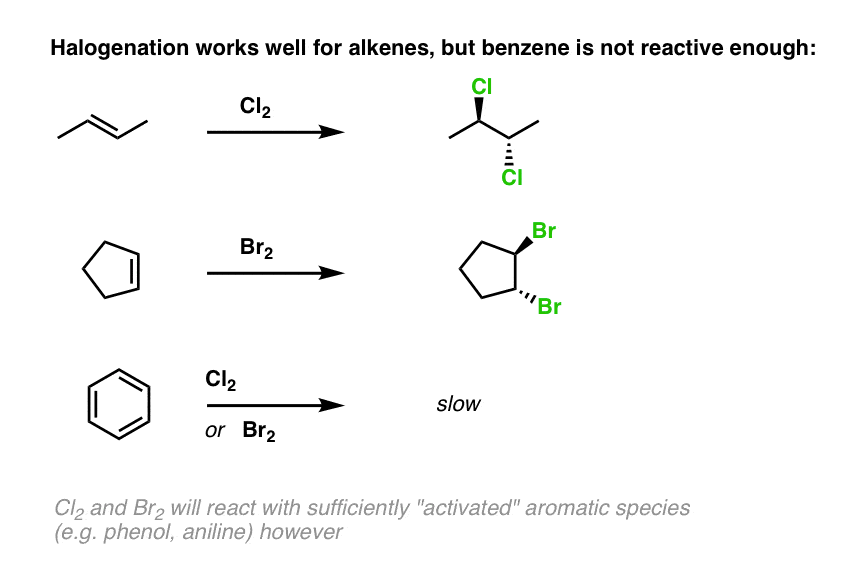
ممکن است به یاد داشته باشید که آلکن ها به راحتی با کلر واکنش می دهند2، برادر2، و من2 برای تشکیل دی هالیدها
بنزن؟ نه چندان و هنگامی که با حلقه های معطر واکنش نشان می دهد، به جای محصولات افزوده، جایگزینی را فراهم می کند.
[Why? Recall that the resonance energy of benzene is about 36 kcal/mol, and electrophilic aromatic substitution disrupts aromaticity. ]
2. اسیدهای لوئیس را می توان برای “فعال کردن” الکتروفیل ها استفاده کرد
خود کلر با مشتقات بنزن “فعال شده” (مانند فنل و آنیلین) واکنش نشان می دهد، اما برای اینکه کلرزنی با آروماتیک های خنثی یا فقیر از الکترون اتفاق بیفتد، نیاز به ضربه زدن به شلوار دارد.
این “لگد به شلوار” توسط اسید لوئیس ارائه می شود. FeCl3 یا AlCl3 استاندارد صنعت هستند، اما در عمل می توان از بسیاری از اسیدهای لوئیس مختلف استفاده کرد.
ممکن است از فصل الکل ها به خاطر بیاورید که اسیدهای پروتیک معمولاً برای تبدیل الکتروفیل های ضعیف (مثلا الکل ها) به الکتروفیل های بهتر با تبدیل الکل به اسید مزدوج آن استفاده می شوند. [post: The Conjugate Acid Is Always A Better Leaving Group]. الکل “فعال شده” سپس می تواند در واکنش های جایگزینی یا حذف هسته دوست شرکت کند که در غیر این صورت نمی توانست در آنها شرکت کند:
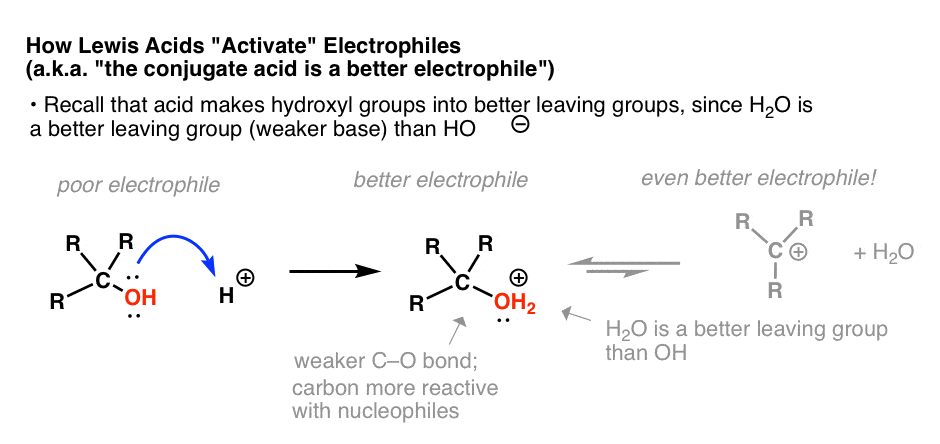
[The leaving group may even depart entirely to give a carbocation, an even better electrophile!]
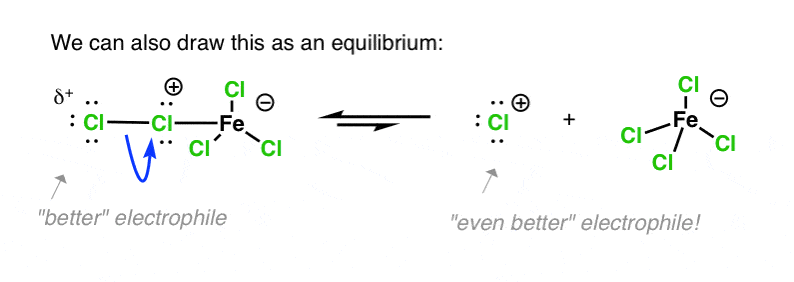
به همین ترتیب، هماهنگی اسید لوئیس با یکی از کلرها، آن را به یک گروه خروجی حتی بهتر تبدیل میکند، با اثر خالص تضعیف پیوند Cl-Cl. حمله به کلر انتهایی توسط یک هسته دوست منجر به از دست دادن آن می شود [Cl-FeCl3]– ، یک گروه ترک حتی بهتر از Cl– .
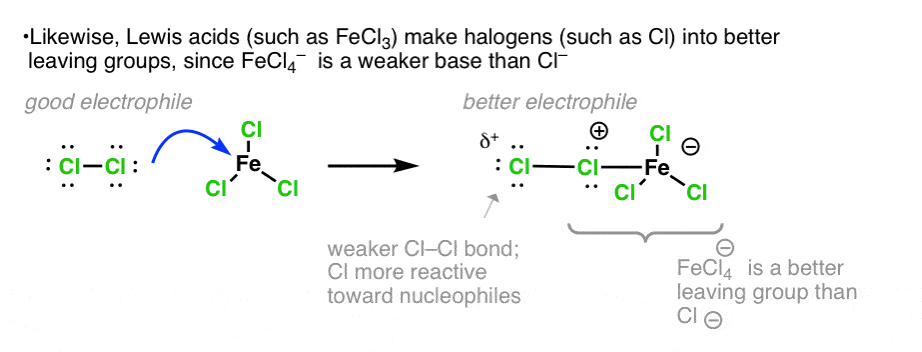
گاهی اوقات ما این را به عنوان یک تعادل ترسیم می کنیم. من شخصا ترجیح می دهم پیوند Cl-Cl دست نخورده را نشان دهم، اما کتاب های درسی متفاوت هستند.
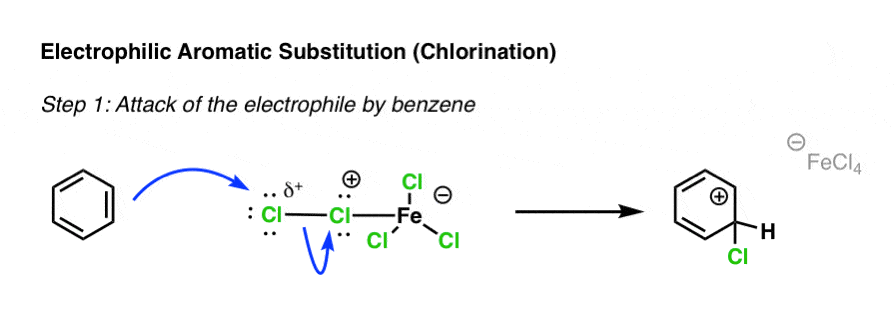
3. کلرزنی الکتروفیلی بنزن
سپس این الکتروفیل “فعال شده” می تواند توسط هسته دوست (حلقه بنزن) در یک واکنش جایگزینی معطر الکتروفیل مورد حمله قرار گیرد. در اینجا C-Cl تشکیل می شود و پیوند CC (pi) می شکند!
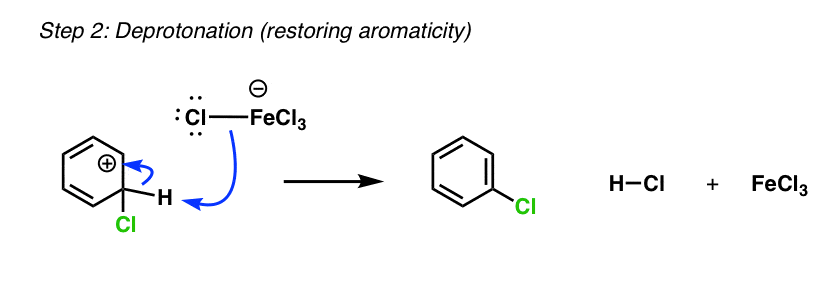
در مرحله بعد، یک باز ضعیف یک پروتون را از حد واسط کربوکاتیون خارج می کند و CH را می شکند و CC (pi) را تشکیل می دهد.
اگر این کمی آشنا به نظر می رسد، به این دلیل است که این مرحله دوم بسیار شبیه مرحله دوم در واکنش E1 است. همانطور که در E1، فقط یک پایه بسیار ضعیف برای حذف یک پروتون مجاور یک کربوکاتیون مورد نیاز است. یون کلرید (Cl– ) انجام خواهد داد.
[Note: there are a lot of different ways to draw this, I’ve only shown one. See this footnote].
محصول نهایی در اینجا کلروبنزن به اضافه یک معادل HCl است. FeCl3 سپس آزاد است تا با معادل دیگری از Cl واکنش دهد2 . به عبارت دیگر، به عنوان یک رفتار می کند کاتالیزور در این واکنش
4. بروماسیون الکتروفیل بنزن
مجموعه ای از اصول مشابه برای برم سازی الکتروفیلیک عمل می کند. در اینجا، اسیدهای لوئیس مورد استفاده اغلب FeBr هستند3 یا AlBr3. [Why not FeCl3 or AlCl3? Good question! See note below ]
اولین مرحله فعال سازی Br است2و به دنبال آن حمله و deprotonation مانند قبل:
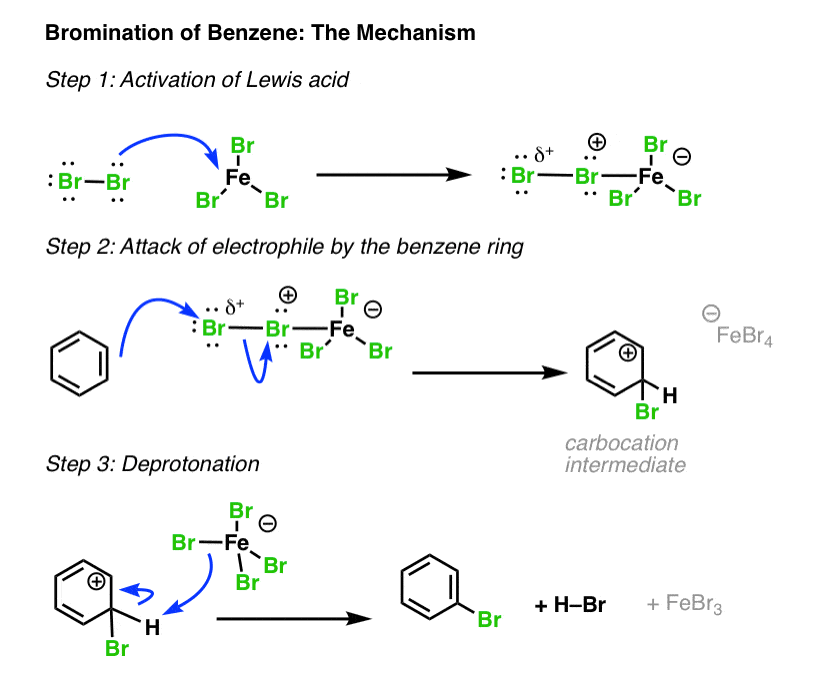
این در اصل همان واکنش کلرزنی است به جز با تعویض هالوژن ها.
5. یدسازی الکتروفیلی بنزن
همچنین می توان بنزن را با استفاده از I یددار کرد2 ، اما مرحله فعال سازی متفاوت است. با این حال، در اینجا معلوم می شود که یک کاتالیزور اسید لوئیس برای تبدیل ید به الکتروفیل فعال کافی برای واکنش با اکثر حلقه های معطر کافی نیست.
در عوض، مقدار استوکیومتری یک اکسید کننده برای تبدیل I استفاده می شود2 به من+ . یک مثال رایج ذکر شده HNO است3که در حضور اسید اضافی (مانند H2بنابراین4) منبع اکسیدان بسیار فعال است [NO2]+ که I2 را به I+ تبدیل می کند. [see note below]

پس از تشکیل، حلقه بنزن با I واکنش می دهد+ در مکانیسم دو مرحله ای جایگزینی آروماتیک الکتروفیل برای ایجاد پیوند کربن-ید جدید.
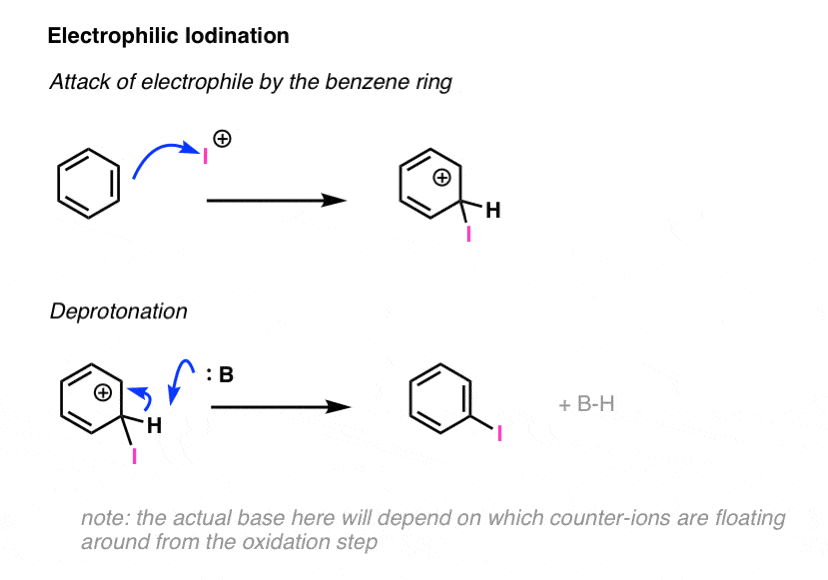
هویت دقیق “B” به اکسیدان مورد استفاده برای تبدیل I بستگی دارد2 به I+ . به عنوان مثال، تنها یک معادل آب این کار را انجام می دهد.
6. خلاصه: هالوژناسیون بنزن
در مورد کلر، برم و ید، جایگزینی معطر الکتروفیل سه مرحله را دنبال می کند.
- فعال سازی الکتروفیل توسط کاتالیزور اسید لوئیس (یا اکسیدان استوکیومتری، در مورد ید)
- حمله الکتروفیل فعال شده توسط حلقه آروماتیک.
- پروتون زدایی برای بازسازی حلقه معطر.
در پست بعدی به دو واکنش مهم جایگزینی معطر الکتروفیل خواهیم پرداخت: سولفونیلاسیون و نیتراسیون، و آنها نیز از این الگوی سه مرحله ای پیروی خواهند کرد!
یادداشت
نکته 1. چند راه مختلف وجود دارد که می توان این را به تصویر کشید. تصویر بالا جفت الکترونهای پیوند Fe-Cl را نشان میدهد که به عنوان پایه عمل میکنند، که اساساً همان تفکیک Cl- از FeCl است.4(-) به دنبال آن به عنوان پایه عمل می کند. همچنین می توان یک جفت تنها را از کلر FeCl ترسیم کرد4 به عنوان پایه عمل می کند و H-Cl-FeCl می دهد3و به دنبال آن باند Fe-Cl شکسته می شود و FeCl می دهد3 و HCl.
نکته 2. بسیاری از اکسیدان های دیگر در این واکنش کاربرد پیدا کرده اند. دیگری برمید مس (II) (CuBr) است2).
نکته 3. آن FeCl نیست3 یا AlCl3 به اندازه کافی قوی نیستند که بتوانند کار را در اینجا انجام دهند. مشکل این است که با استفاده از Br2 در حضور FeCl3 منجر به درهم آمیختگی هالوژن ها می شود که در نتیجه مقدار کمی محصولات کلر می شود. استفاده از نمک های بروماید این مشکل را برطرف می کند.
خودت امتحان کن
(پیشرفته) مراجع و مطالعه بیشتر
برای مراجع دقیق تر در مورد واکنش های هالوژناسیون فردی (کلرزنی، برم زایی، یدزایی)، به بخش های راهنمای واکنش مراجعه کنید. مراجع در اینجا نکات برجسته هستند.
فلوئوراسیون معطر الکتروفیلیک است ممکن است، و دو مقاله آخر آن را توصیف می کنند.
کلر زنی معطر الکتروفیلیک:
- سینتیک جایگزینی هالوژن معطر قسمت چهارم ۱- هالوژنونفتالین ها و ترکیبات مرتبط
PBD de la Mare و PW Robertson
جی. شیمی. اجتماعی، 1948، 100-106
DOI: 10.1039/JR9480000100
مقاله اولیه ای که سینتیک هالوژناسیون آروماتیک الکتروفیل را مطالعه می کند. - جایگزینی معطر XVII. کلرید آهن و کلرید آلومینیوم کاتالیزور کلرزنی بنزن، آلکیل بنزن ها و هالوبنزن ها
جورج A. Olah، Stephen J. Kuhn، و Barbara A. Hardie
مجله انجمن شیمی آمریکا 1964، 86 (6)، 1055-1060
DOI: 10.1021/ja01060a017 - نرخ کلرزنی بنزن، تولوئن و زایلن ها. عوامل نرخ جزئی برای واکنش کلر
هربرت سی براون و لئون ام استاک
مجله انجمن شیمی آمریکا 1957، 79 (19)، 5175-5179
DOI: 1021/ja01576a025بروماتیک معطر الکتروفیل: - نرخ های نسبی بروماسیون بنزن و متیل بنزن ها. عوامل نرخ جزئی برای واکنش برم
هربرت سی براون و لئون ام استاک
مجله انجمن شیمی آمریکا 1957، 79 (6)، 1421-1425
DOI: 1021/ja01563a040 - جایگزینی معطر چهاردهم فریک کلرید کاتالیز برم بنزن و آلکیل بنزن با برم در محلول نیترومتان
جورج آ. اولا، استفن جی. کوهن، سیلویا اچ. فلود و باربارا ای. هاردی
مجله انجمن شیمی آمریکا 1964، 86 (6)، 1039-1044
DOI: 10.1021/ja01060a014 - جایگزینی معطر XV. کلرید آهن کاتالیزور بروماسیون هالوبنزن ها در محلول نیترومتان
جورج آ. اولا، استفن جی. کوهن، سیلویا اچ فلود، و باربارا ای. هاردی
مجله انجمن شیمی آمریکا 1964، 86 (6)، 1044-1046
DOI: 1021/ja01060a015 یدسازی معطر الکتروفیلیک: - هالوژناسیون با هالیدهای مس (II). سنتز آریل یدیدها
ویلیام سی بیرد و جان اچ. سرریج
مجله شیمی آلی 1970، 35 (10)، 3436-3442
DOI: 10.1021/jo00835a055
یک روش ساده و سرراست برای سنتز مونویدوآرن ها با استفاده از CuI2 به عنوان عامل یددار - فلوئوراسیون الکتروفیلیک آروماتیک ها با Selectfluor™ و تری فلورومتان سولفونیک اسید
تاتیانا شاما، هرویگ بوخهولز، جی کی سوریا پراکاش و جورج ا.
اسرائیل جی. شیمی. 1999، 39 (2)، 207-210
DOI: 1002/ijch.199900026
این مقاله استفاده از Selectfluor™ را به عنوان یک معرف برای فلوئوراسیون معطر الکتروفیل توصیف می کند. Selectfluor یک جامد تجاری در دسترس است که به راحتی قابل حمل است و منبع مناسبی از “F+” به دلیل پیوند NF. - فلوراسیون C-H آروماتیک الکتروفیل کاتالیز شده با پالادیوم
کومیکو یاماموتو، جیاکون لی، جفری آئو گاربر، جولیان دی. رولفس، گریگوری بی بورسالیان، جانیک سی بورگس، کریستوف جنیکوت، جروم ژاک، موریس ون گاستل، فرانک نیسی و توبیاس ریتر
طبیعت 2018، 554، 511–514
DOI: 10.1038/nature25749
این مقاله پیشرفته تر است و یک موضوع فعلی در شیمی آلی فلزی – استفاده از فلوریدهای Pd (IV) برای فلوئوراسیون را پوشش می دهد. برای کسانی که ادبیات را دنبال می کنند، پروفسور ملانی سانفورد (ایالات متحده آمریکا) و پروفسور توبیاس ریتر (این مقاله، هاروارد، اکنون در موسسه ماکس پلانک (آلمان)) در مورد این موضوع به عقب و جلو رفته اند.
