سه عاملی که بر پایداری کربوکاتیون تأثیر می گذارد
سه عامل اصلی باعث افزایش پایداری کربوکاتیون ها می شود:
- افزایش تعداد مجاور اتم های کربن: متیل (کربوکاتیون با حداقل پایداری) <اولیه <ثانویه <ثالثیه (پایدارترین کربوکاتیون)
- پیوندهای پی مجاور که به اوربیتال کربوکاتیون p اجازه می دهد تا بخشی از یک سیستم پی مزدوج باشد (“جداسازی از طریق رزونانس”)
- اتم های مجاور با جفت های تنها
جزئیات بیشتر در زیر
فهرست مطالب
- سه عاملی که کربوکاتیون ها را تثبیت می کنند
- کربوکاتیون ها توسط اتم های کربن همسایه تثبیت می شوند
- کربوکاتیون ها با پیوندهای چندگانه کربن-کربن همسایه تثبیت می شوند
- کربوکاتیون ها توسط اتم های مجاور که دارای جفت های تنها هستند تثبیت می شوند
- تشکیل کربوکاتیون اغلب مرحله محدودکننده سرعت در مکانیزم واکنش است. بنابراین با درک چگونگی تثبیت کربوکاتیون ها، می توانید تأثیر جانشین ها بر نرخ واکنش را درک کنید.
- (پیشرفته) مراجع و مطالعه بیشتر
1. سه عاملی که کربوکاتیون ها را تثبیت می کنند
اگر الکترون ها پول بودند، کربوکاتیون ها گدایان شیمی آلی بودند. این واسطههای دارای کمبود الکترون که تنها شش الکترون ظرفیتی را در خود جای دادهاند، در بسیاری از واکنشهایی که در شیمی آلی با آنها مواجه میشویم، برجسته هستند، مانند
این یک تکه بزرگ از O-chem سال دوم است، همانجا.
به دلیل کمبود الکترون (و در نتیجه ناپایدار)، تشکیل کربوکاتیون معمولاً مرحله محدود کننده سرعت در این واکنش ها است.
با دانستن این موضوع، پس به این فکر کنید: هنگامی که ماده میانی کربوکاتیون پایدارتر شود، چه اتفاقی برای سرعت واکنش می افتد؟ خوب، انرژی حالت گذار منجر به واکنش کمتر خواهد بود. بنابراین، انرژی فعال سازی کاهش خواهد یافت.
با سرعت واکنش چه خواهد کرد؟ از آنجایی که انرژی فعال سازی کاهش می یابد، واکنش سریع تر می شود.
بنابراین برخی از عواملی که کربوکاتیون ها را تثبیت می کنند چیست؟
اگر تمام کتاب درسی شیمی آلی خود را مرور کنید، 3 عامل ساختاری اصلی را خواهید یافت که به تثبیت کربوکاتیون ها کمک می کند.
- اتم های کربن همسایه
- پیوندهای چندگانه کربن-کربن همسایه.
- اتم های همسایه با جفت های تنها.
چرا این هست؟ همه چیز به نیروی اصلی حاکم در شیمی برمی گردد: الکترواستاتیک. از آنجایی که “بارهای مخالف جذب می شوند، مانند دفع بارها”، شما درست فکر می کنید کربوکاتیون ها توسط گروه های الکترون دهنده نزدیک تثبیت می شوند.
بیایید به ترتیب به هر یک از این موارد نگاه کنیم.
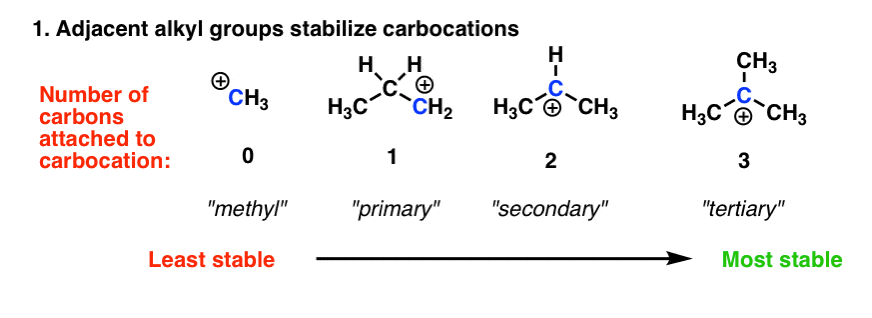
2. کربوکاتیون ها توسط اتم های کربن همسایه تثبیت می شوند.
با رفتن از کربن های اولیه به ثانویه به ثالثیه، پایداری کربوکاتیون ها افزایش می یابد. دو پاسخ در مورد چرایی این وجود دارد. پاسخ قدیمی که هنوز در بسیاری از کتاب های درسی مقدماتی وجود دارد، به کربن ها (به ویژه گروه های آلکیل) به عنوان گروه های “الکترون آزاد کننده” از طریق اثرات القایی اشاره می کند. یعنی یک کربن (الکترونگیتی 2.5) متصل به هیدروژن (الکترون منفی 2.2) غنی از الکترون خواهد بود و می تواند بخشی از آن الکترون ها را به کربوکاتیون مجاور اهدا کند. به عبارت دیگر، کربن همسایه با الکترونهایی که از هیدروژنها میدزدد، کربوکاتیون را میپردازد. دوم، (و از لحاظ نظری توضیح رضایتبخشتر) هایپرکونژوگاسیون است که از طریق اهدای الکترونهای پیوندهای سیگما CH به اوربیتال خالی p کربوکاتیون تثبیت میشود.
توضیح هرچه که باشد، این عامل بر بسیاری از واکنشهای کلیدی که در سازمان 1 با آنها برخورد میکنید، کنترل میکند – از قانون مارکوفنیکف، تا بازآراییهای کربوکاتیون، از طریق درک واکنشهای SN1 و E1.
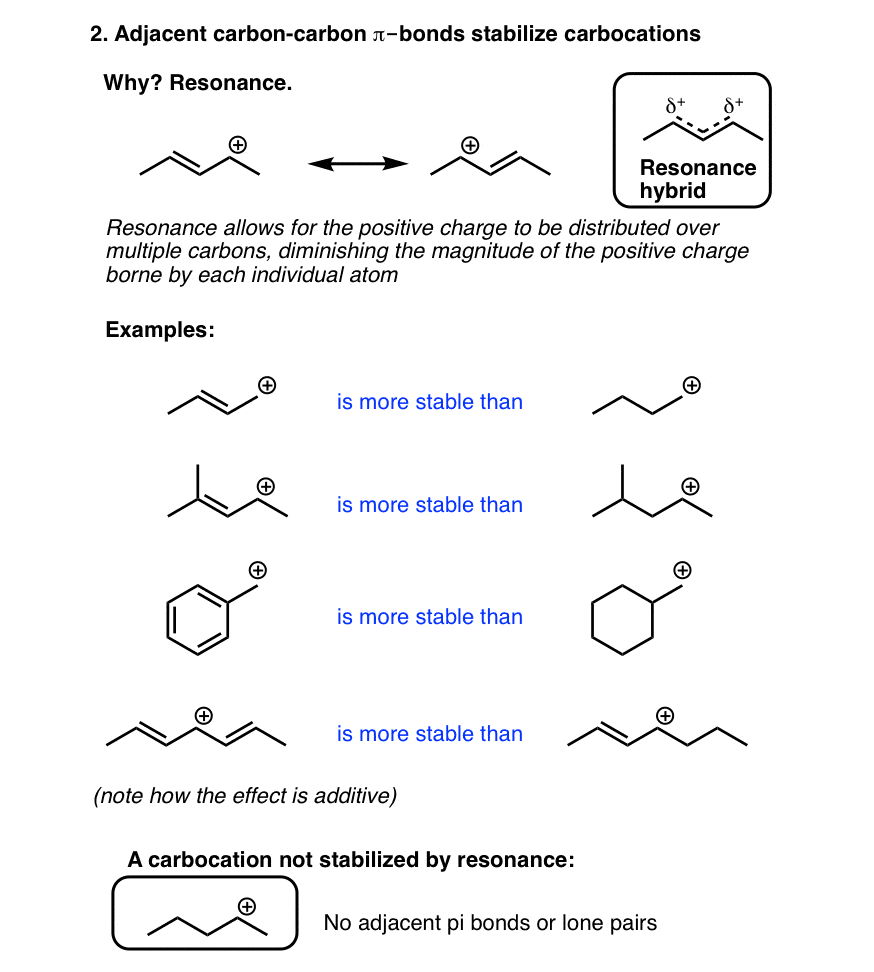
3. کربوکاتیون ها با پیوندهای چندگانه کربن-کربن همسایه تثبیت می شوند
کربوکاتیونهای مجاور یک پیوند دو یا سهگانه کربن-کربن دیگر، پایداری ویژهای دارند، زیرا همپوشانی بین اوربیتال p خالی کربوکاتیون با اوربیتالهای p پیوند π، امکان تقسیم بار بین اتمهای متعدد را فراهم میکند. این اثر که «محلیزدایی» نامیده میشود با ترسیم ساختارهای تشدید که در آن بار از اتم به اتم «حرکت» میکند، نشان داده میشود. این تأثیر تثبیتکنندهای است که حتی کربوکاتیونهای اولیه – معمولاً بسیار ناپایدار – در مجاورت یک پیوند دوگانه بهطور قابلتوجهی به راحتی تشکیل میشوند، به طوری که آنها واقعاً در واکنشهای SN1 شرکت میکنند.
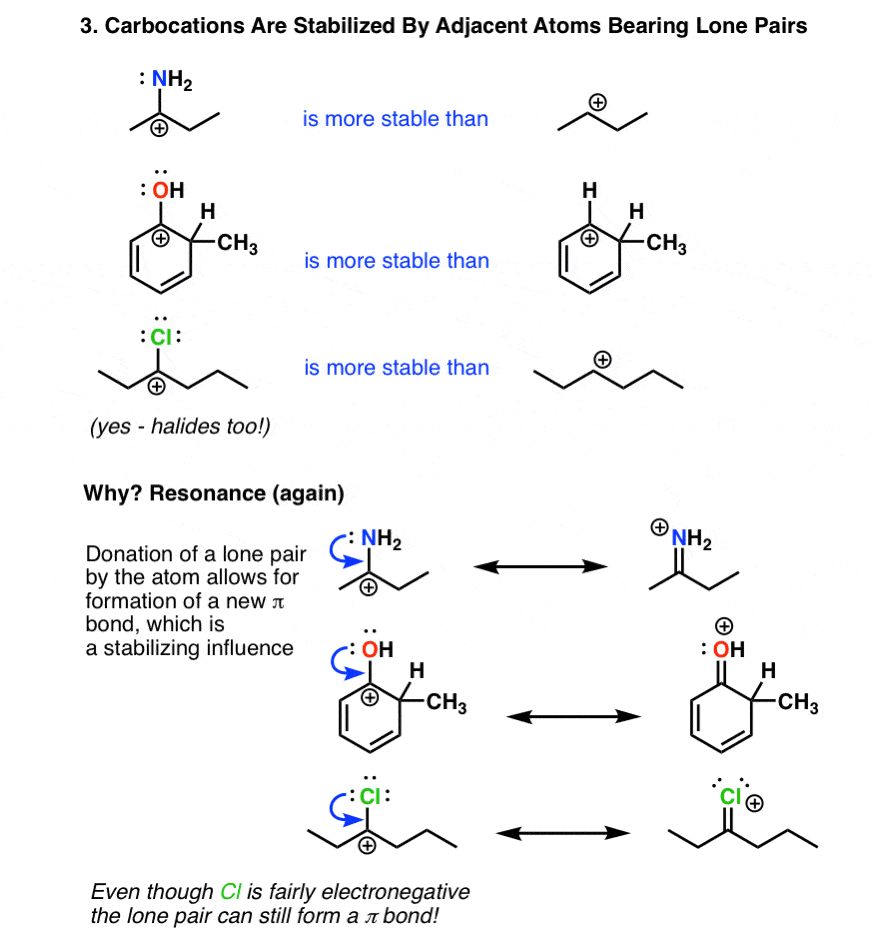
4. کربوکاتیون ها توسط اتم های مجاور که دارای جفت های تنها هستند تثبیت می شوند
تاثیر کلیدی تثبیت کننده یک اتم همسایه است که یک جفت الکترون را به کربوکاتیون فقیر از الکترون اهدا می کند. در اینجا توجه داشته باشید که این امر همیشه منجر به تشکیل a می شود پیوند دوگانه (پیوند π) و بار به اتم اهدا کننده جفت الکترون منتقل می شود. از این رو این اغلب با نام “اهدای π” خوانده می شود.
قدرت این اثر با پایه متفاوت است، بنابراین نیتروژن و اکسیژن قدرتمندترین اهداکنندگان π هستند. به اندازه کافی عجیب، حتی هالوژن ها می توانند از طریق اهدای یک جفت تنها به تثبیت کربوکاتیون ها کمک کنند. این واقعیت که اتمهایی که معمولاً بهعنوان الکترونکشنده فکر میکنیم (نیتروژن، اکسیژن، کلر) میتوانند در واقع گروههای اهداکننده الکترون باشند، احتمالاً یکی از سختترین عوامل برای پیچیدن سر در Org 2 است.
این اثر در واکنشهای حلقههای معطر و همچنین در شیمی انولات بسیار مهم است، جایی که پیوندهای دوگانه متصل به گروههای اهداکننده (به ویژه نیتروژن و اکسیژن) میتواند میلیونها (یا میلیاردها) برابر بیشتر از آلکنهایی باشد که فاقد این گروهها هستند، هسته دوستتر باشند.
نکته اصلی این پست این است که با درک عواملی که بر پایداری کربوکاتیونها تأثیر میگذارند، میتوانید بینش فوقالعادهای در مورد بسیاری از واکنشهای مختلف به دست آورید، حتی اگر آنها بسیار متفاوت به نظر برسند.
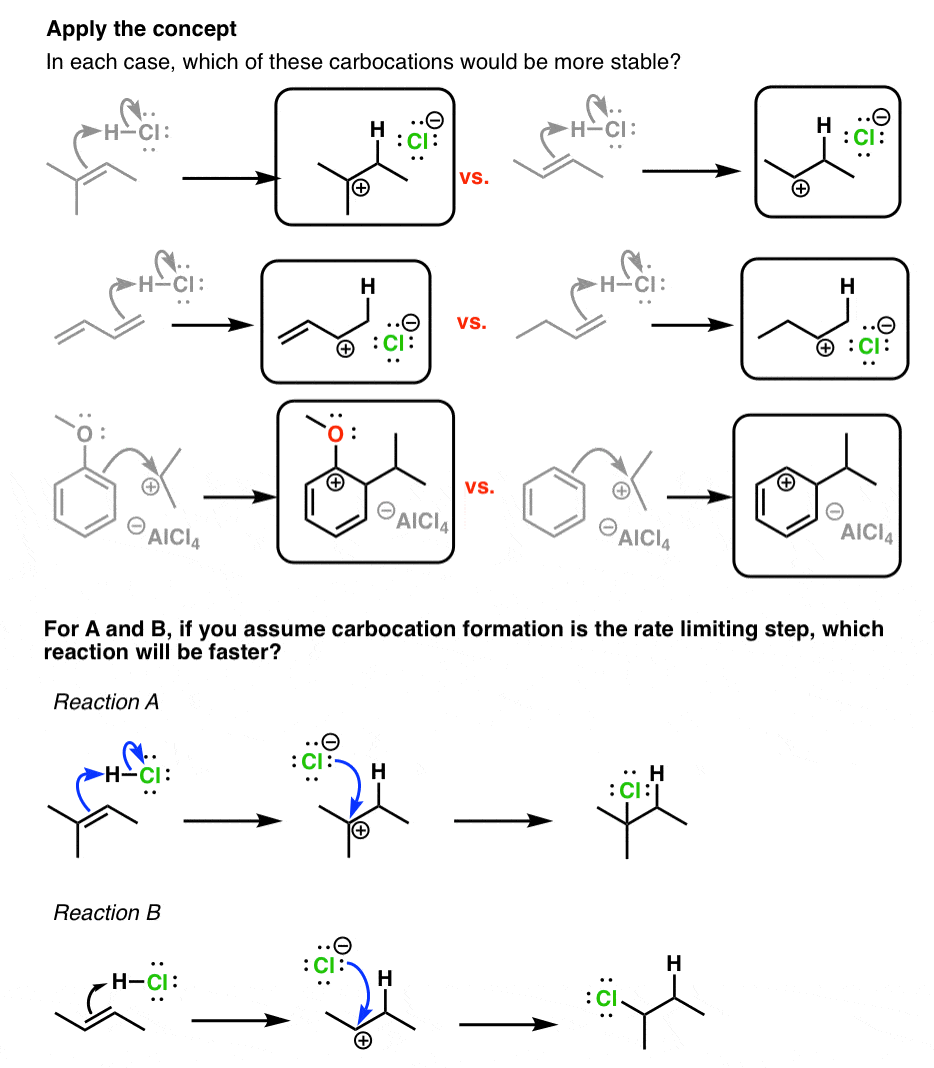
5. تشکیل کربوکاتیون اغلب مرحله محدودکننده سرعت در مکانیزم واکنش است. بنابراین با درک چگونگی تثبیت کربوکاتیون ها، می توانید تأثیر جانشین ها بر نرخ واکنش را درک کنید.
چرا این مهم است؟ بسیاری از واکنش ها از واسطه های کربوکاتیونی عبور می کنند. به نظر شما اثر تثبیت کربوکاتیون بر روی سرعت واکنش چه خواهد بود؟ در اینجا چند نمونه خاص آورده شده است.
(پیشرفته) مراجع و مطالعه بیشتر
تعداد زیادی مقاله در مورد روش های مختلف تجربی و نظری برای تعیین کمی پایداری نسبی کربوکاتیون ها، هم در فاز گاز و هم در محلول (معمولاً سوپراسید) نوشته شده است.
- آماده سازی کمی و آنتالپی بازآرایی کاتیون ثانیه بوتیل
W. Bittner، EM Arnett، و M. Saunders
مجله انجمن شیمی آمریکا 1976، 98 (12)، 3734-3735
DOI: 10.1021/ja00428a072
این مقاله یک روش کالریمتری جدید را برای اندازهگیری گرمای ایزومریزاسیون تشریح میکند ثانیهکاتیون بوتیل به ترتکاتیون بوتیل در محلول سوپراسید با استفاده از این مقدار به دست آمده 0.5 ± 14.5 kcal/mol است. - پایداری کربوکاتیون ها در محلول 14. مقیاس ترموشیمیایی توسعه یافته پایداری کربوکاتیون در یک سوپراسید معمولی
ادوارد ام. آرنت و توماس سی. هوفلیچ
مجله انجمن شیمی آمریکا 1983، 105 (9)، 2889-2895
DOI: 10.1021/ja00347a060
این مقاله جدولی از پایداری 39 کربوکاتیون را ارائه می دهد که به صورت کالریمتری با گرمای تشکیل (یونیزاسیون در سوپراسید از کربینول مربوطه) اندازه گیری می شود. - یون های کربنیوم I. تابع اسیدیته (C0) مشتق شده از تعادل یون آریل کربنیم
سی. دنو، جی جی یاروزلسکی و آلن شریشهایم
مجله انجمن شیمی آمریکا 1955، 77 (11)، 3044-3051
DOI: 10.1021/ja01616a036
پایداری کربوکاتیون را می توان در p نیز بیان کردکR+، که در مقاله تعریف شده است. کربوکاتیون های مورد مطالعه در این مقاله همگی یون های آریل کربنیوم نسبتاً پایدار هستند. - ترکیبات هیدریدی یون های کربنیوم در محلول استونیتریل و دی متیل سولفوکسید
جین پی چنگ، کیشان ال. هاندو، و ورنون دی. پارکر
مجله انجمن شیمی آمریکا 1993، 115 (7)، 2655-2660
DOI: 10.1021/ja00060a014
پایداری کربوکاتیون را می توان بر حسب میل ترکیبی هیدرید نیز بیان کرد (R+ + اچ– -> RH). کربوکاتیونهای مورد مطالعه در این مقاله نیز یونهای آریل کربنیوم نسبتاً پایدار هستند، زیرا اینها به صورت الکتروشیمیایی در DMSO یا استونیتریل اندازهگیری میشوند. - طیف سنجی فوتوالکترون رادیکال های متیل، اتیل، ایزوپروپیل و ترت بوتیل. مفاهیمی برای ترموشیمی و ساختار رادیکالها و یونهای کربنیوم مربوط به آنها
A. Houle و JL Beauchamp
مجله انجمن شیمی آمریکا 1979، 101 (15)، 4067-4074
DOI: 10.1021/ja00509a010
جدول III در این مقاله دارای گرمای تشکیل برای کاتیون های آلکیل پایه (متیل، اتیل، ایزوپروپیل و تی-بوتیل)، اما در فاز گاز است. اعداد با شهود آزمایشهای فاز راهحل موافق هستند. پایداری از متیل -> اتیل -> ایزوپروپیل -> تی بوتیل افزایش می یابد.
