قطبی پروتیک در مقابل قطبی آپروتیک در مقابل غیرقطبی: درباره حلال ها در شیمی آلی
بسیاری از دانش آموزانی که با آنها صحبت می کنم در مورد حلال ها سؤالاتی دارند.
حلال ها می توانند باعث سردرگمی قابل توجهی در واکنش ها شوند، زیرا آنها همراه با معرف های یک واکنش فهرست شده اند، اما اغلب در واقع در خود واکنش شرکت نمی کنند. و صادقانه بگویم، بسیاری از مربیان (از جمله خود من) در مورد اینکه چه زمانی حلال ها را بگنجانند و چه زمانی نباید آن ها را بگنجانند، چندان سازگار نیستند. بنابراین، کل تمرین می تواند تا حدودی دلبخواه باشد: چه زمانی می دانید که چه زمانی باید حلال را وارد کنید؟
فهرست مطالب
- حلال چیست؟
- “قطبی” و “غیر قطبی” به چه معناست؟
- تمایز بین حلال های “پروتیک” و “آپروتیک”.
- حلال های غیر قطبی: یک جدول
- حلال های قطبی آپروتیک “مرز”.
- حلال های قطبی آپروتیک: یک جدول
- حلال های قطبی پروتیک: یک جدول
- یادداشت
1. حلال چیست؟
بیایید پشتیبان گیری کنیم. به هر حال حلال چیست؟
حلال یک است مایع که به عنوان وسیله ای برای واکنش عمل می کند. می تواند دو هدف عمده را دنبال کند:
- (غیر مشارکتی) برای حل کردن واکنش دهنده ها “مثل مانند را حل می کند” را به خاطر دارید؟ حلال های قطبی برای حل کردن واکنش دهنده های قطبی (مانند یون ها) بهترین هستند. حلال های غیر قطبی برای حل کردن واکنش دهنده های غیرقطبی (مانند هیدروکربن ها) بهترین هستند.
- مشارکتی: به عنوان منبع اسید (پروتون) پایه (حذف پروتون ها)، یا به عنوان یک هسته دوست (اهدای یک جفت الکترون تنها). تنها دسته ای از حلال ها که معمولاً باید نگران آن باشید، حلال های قطبی پروتیک هستند (به زیر مراجعه کنید).
2. حلال های قطبی دارای گشتاورهای دوقطبی بزرگ هستند. حلال های غیر قطبی ممان دوقطبی کوچک یا صفر دارند
خوب. بنابراین “قطبی” و “غیر قطبی” به چه معناست؟
- حلال های قطبی دارای گشتاورهای دوقطبی بزرگ (با نام مستعار “شارژهای جزئی”)؛ آنها حاوی پیوندهایی بین اتم ها با الکترونگاتیوی بسیار متفاوت مانند اکسیژن و هیدروژن هستند.
- حلال های غیر قطبی حاوی پیوندهایی بین اتم هایی با الکترونگاتیوی مشابه، مانند کربن و هیدروژن (به هیدروکربن ها مانند بنزین فکر کنید). پیوندهای بین اتم هایی با الکترونگاتیوی مشابه فاقد بار جزئی خواهند بود. این نبود بار است که این مولکول ها را «غیر قطبی» می کند.
دو روش مستقیم برای اندازه گیری قطبیت وجود دارد. یکی از طریق اندازه گیری ثابتی به نام “ثابت دی الکتریک” یا گذردهی است. هرچه ثابت دی الکتریک بیشتر باشد، قطبیت (آب = زیاد، بنزین = کم) بیشتر است. یک ثانیه از اندازه گیری مستقیم گشتاور دوقطبی حاصل می شود.
قطبیت یک است پیوستگی. در حالی که همه ما می توانیم موافق باشیم که پنتان “غیر قطبی” و آب “قطبی” است، موارد مرزی مانند دی اتیل اتر، دی کلرومتان و تتراهیدروفوران (THF) وجود دارد که دارای ویژگی های قطبی و غیر قطبی هستند. به طور کلی، یک خط جداکننده خوب بین “قطبی” و “غیر قطبی” امتزاج پذیری با آب است. دی اتیل اتر و دی کلرومتان با آب مخلوط نمی شوند. THF، DMSO، استونیتریل، DMF، استون و الکل های زنجیره کوتاه انجام می دهند.
3. حلال های “پروتیک” دارای پیوندهای OH یا NH هستند و می توانند با خود پیوند هیدروژنی برقرار کنند. حلال های “آپروتیک” نمی توانند اهدا کننده پیوند هیدروژنی باشند
تمایز نهایی وجود دارد و این نیز باعث سردرگمی می شود. برخی از حلال ها را “پروتیک” و برخی را “آپروتیک” می نامند. به هر حال چه چیزی یک حلال را به یک حلال “پروتیک” تبدیل می کند؟
- حلال های پروتیک دارای پیوندهای OH یا NH هستند. چرا این مهم است؟ زیرا حلال های پروتیک می توانند در پیوند هیدروژنی که یک نیروی بین مولکولی قدرتمند است شرکت کنند. علاوه بر این، این پیوندهای OH یا NH می توانند به عنوان منبع پروتون (H+) عمل کنند.
- حلال های آپروتیک ممکن است جایی روی آنها هیدروژن باشد، اما فاقد پیوندهای OH یا NH هستند و بنابراین نمی تواند پیوند هیدروژنی برقرار کند با خودشان
برای متوسط دانشجوی ترم اول، این تمایزها در واکنشهای جایگزینی، جایی که حلالهای پیوند هیدروژنی تمایل به کاهش واکنشپذیری نوکلئوفیلها دارند، بیشتر به چشم میخورد. از سوی دیگر، حلال های آپروتیک قطبی این کار را نمی کنند.
معمولاً 3 نوع حلال وجود دارد: غیرقطبی، قطبی آپروتیک و قطبی. (چیزی به نام حلال پروتیک غیر قطبی وجود ندارد).
4. غیر قطبی Sاجاق گازها لحظه دوقطبی کمی دارند
این حلال ها ثابت دی الکتریک پایینی دارند (<5) و حلال های خوبی برای گونه های باردار مانند آنیون ها نیستند. با این حال دی اتیل اتر (Et2O) یک حلال رایج برای واکنش های گریگنارد است. جفت های تک آن از پایه لوئیس هستند و می توانند به حل شدن کاتیون منیزیم کمک کنند.
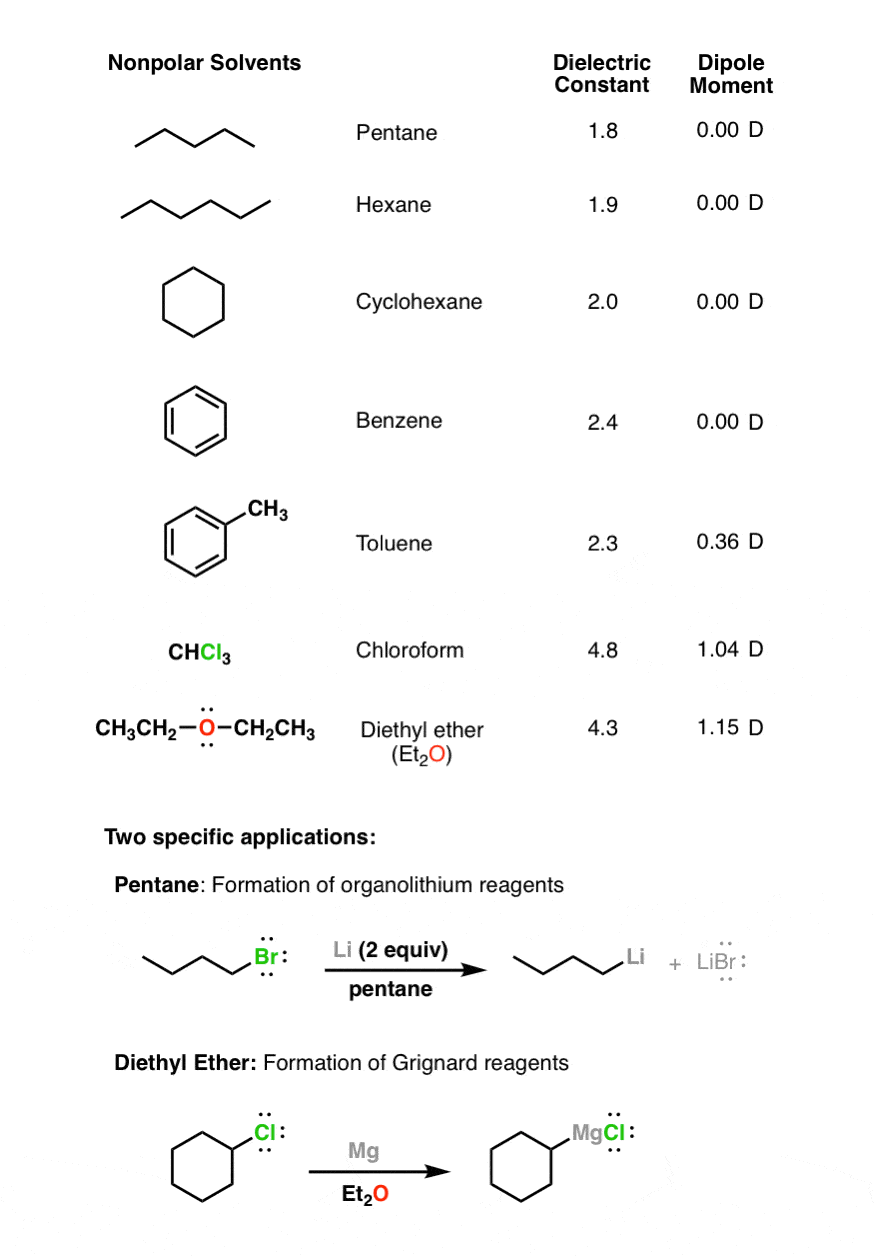
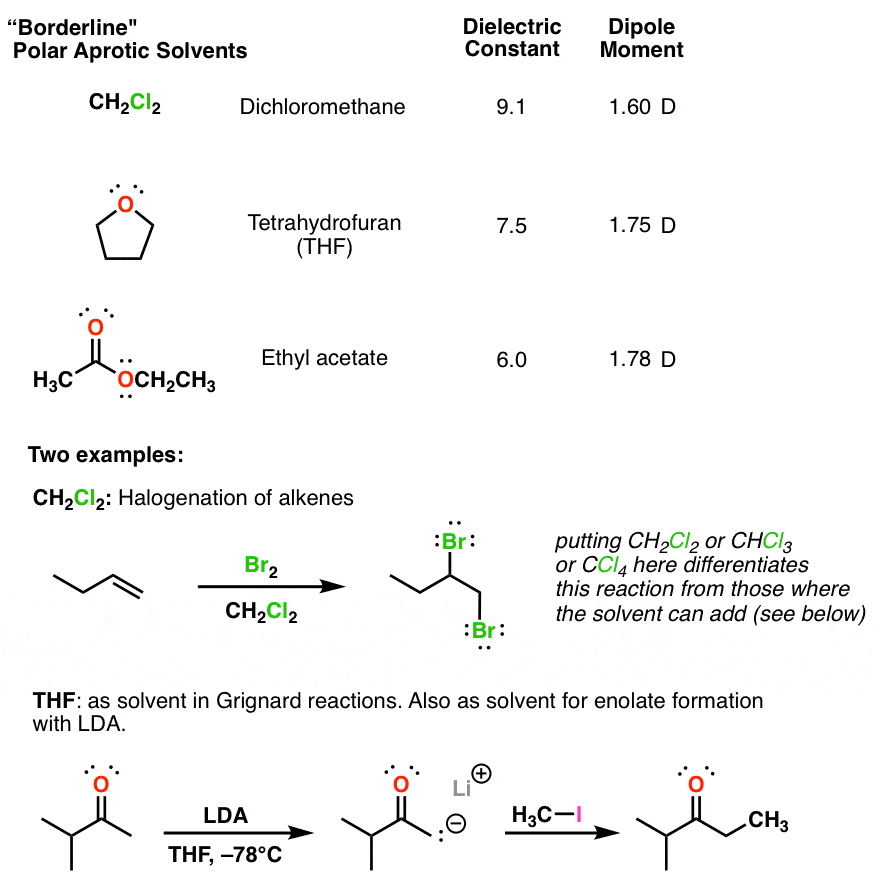
5. حلال های قطبی آپروتیک “مرز” دارای گشتاورهای دوقطبی کوچک و ثابت دی الکتریک پایین (<10) هستند.
این حلال ها دارای ثابت دی الکتریک نسبتاً بالاتری نسبت به حلال های غیرقطبی (بین 5 تا 20) هستند. از آنجایی که آنها قطبیت متوسطی دارند، حلالهای «عمومی» خوبی برای طیف وسیعی از واکنشها هستند. آنها “آپروتیک” هستند زیرا فاقد پیوندهای OH یا NH هستند. برای اهداف ما، آنها در واکنش ها شرکت نمی کنند: آنها فقط به عنوان رسانه عمل می کنند.
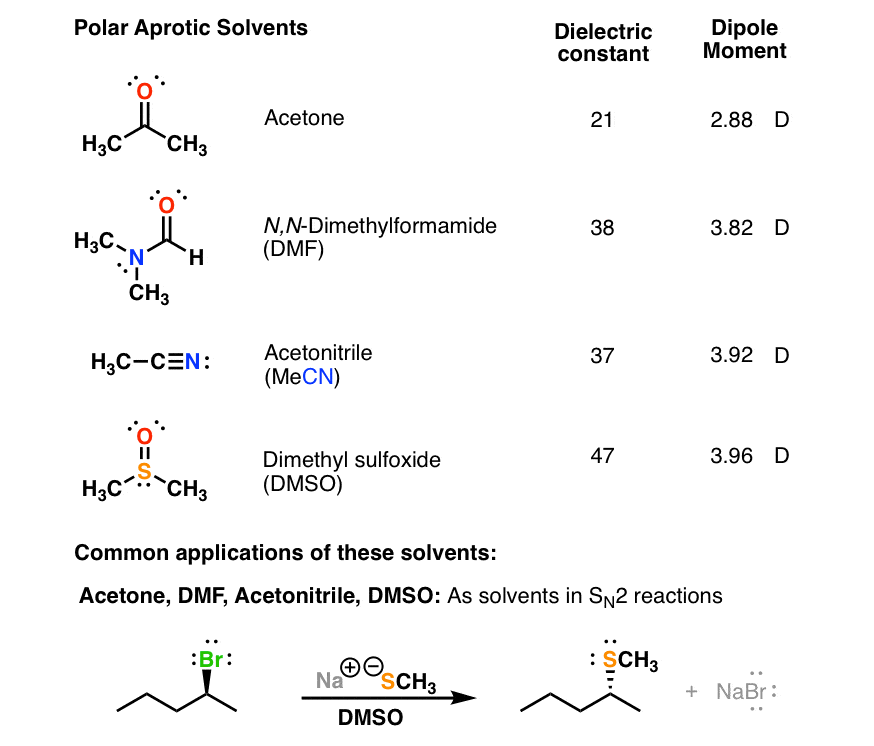
6. چهار حلال کلیدی قطبی آپروتیک با ثابت های دی الکتریک بزرگ (بیش از 10)
این حلال ها همگی دارای ثابت دی الکتریک بزرگ (بیش از 20) و گشتاورهای دوقطبی بزرگ هستند، اما در پیوند هیدروژنی شرکت نمی کنند (بدون پیوند OH یا NH). قطبیت بالای آنها به آنها اجازه می دهد تا گونه های باردار مانند آنیون های مختلف مورد استفاده به عنوان هسته دوست (مانند CN(-)، HO(-) و غیره را حل کنند. فقدان پیوند هیدروژنی در حلال به این معنی است که این هسته دوست ها در محلول نسبتا “آزاد” هستند و آنها را واکنش پذیرتر می کند. برای اهداف ما این حلال ها در واکنش ها شرکت نمی کنند.
7. حلالهای قطبی پروتیک: یک جدول
حلال های پروتیک قطبی دارای ثابت دی الکتریک بالا و گشتاورهای دوقطبی بالا هستند. علاوه بر این، از آنجایی که آنها دارای پیوندهای OH یا NH هستند، می توانند در پیوند هیدروژنی نیز شرکت کنند. این حلال ها همچنین می توانند به عنوان اسیدها (منبع پروتون ها) و هسته دوست های ضعیف (تشکیل پیوند با الکتروفیل های قوی) عمل کنند.
آنها بیشتر به عنوان حلال برای پایه های مزدوج خود استفاده می شوند. (مثلا H2O به عنوان حلال برای HO(-) استفاده می شود. EtOH به عنوان حلال برای EtO(-) استفاده می شود. )
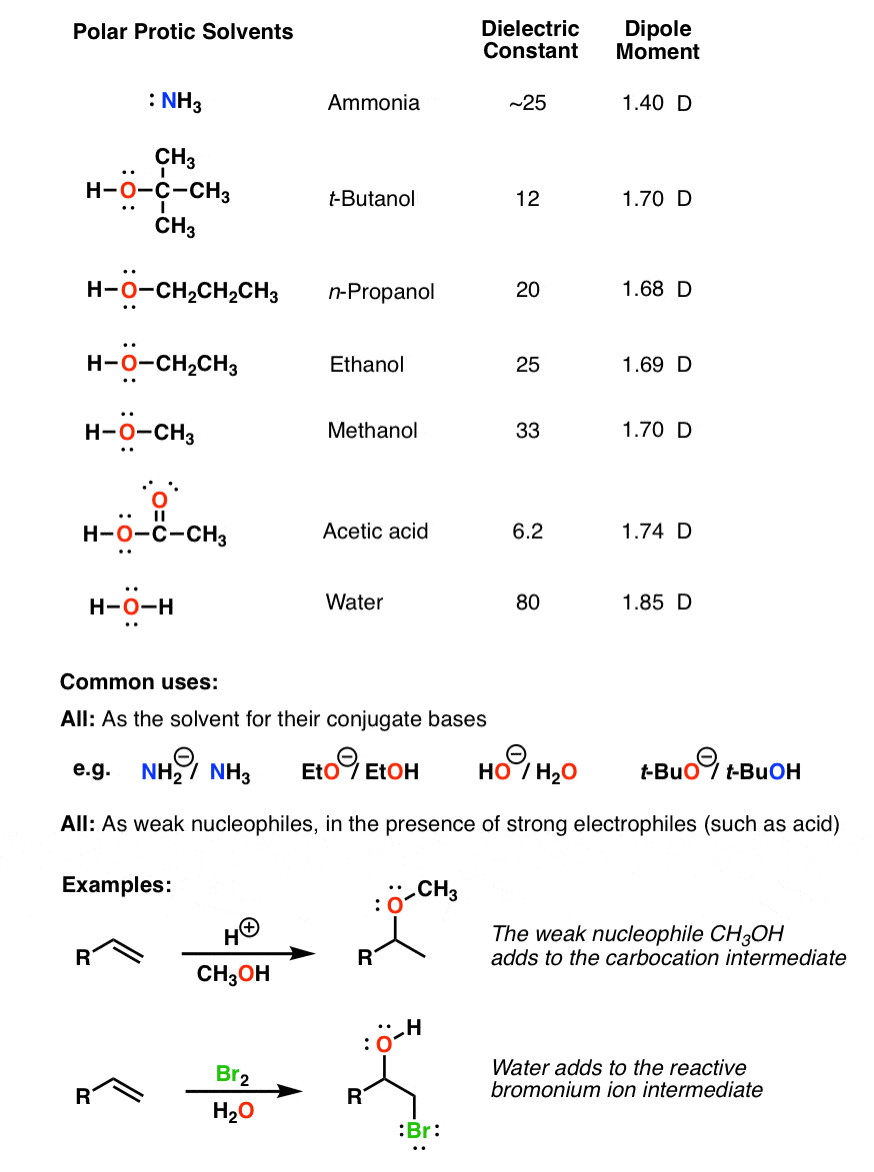
این نوع حلال ها به احتمال زیاد در واکنش ها شرکت می کنند. مثالهای زیادی وجود دارد (بیش از آن که بتوان فهرست کرد) که در آن یک حلال پروتیک قطبی مانند آب، متانول یا اتانول میتواند به عنوان هسته دوست در واکنش عمل کند، اغلب زمانی که یک الکتروفیل قوی (مانند اسید) وجود دارد. بنابراین اگر این نوع حلال را مشاهده کردید، مراقب باشید.
منبع داده ها: ویکی پدیا
